Por Que a Cromatografia de Exclusão de Tamanho Está Revolucionando o Isolamento de Exossomos Seminais
Exossomos são vesículas extracelulares nanométricas (50-200 nm) que atuam como mensageiros intercelulares, transportando proteínas, lipídios e material genético entre células. No plasma seminal, essas estruturas desempenham papel fundamental na função reprodutiva masculina. Segundo a Organização Mundial da Saúde (OMS) , a análise do sêmen representa uma ferramenta diagnóstica essencial para avaliação da fertilidade masculina, e os exossomos seminais emergem como biomarcadores promissores neste contexto.
Uma publicação recente na revista Biomedicines (outubro de 2025) demonstrou que a cromatografia de exclusão de tamanho (SEC) supera significativamente a ultracentrifugação no isolamento de exossomos seminais.
Equipamento utilizado na pesquisa
O estudo, conduzido por pesquisadores da Tulane University School of Medicine e Ravenshaw University, identificou 3.315 proteínas em exossomos isolados por SEC contra apenas 931 pela técnica tradicional — uma diferença de mais de 250%.
A caracterização física dessas vesículas, incluindo concentração de partículas, distribuição de tamanho e potencial zeta, foi realizada por meio de Nanoparticle Tracking Analysis (NTA) com o sistema ZetaView® PMX-430-Z QUATT da Particle Metrix , confirmando a superioridade da SEC em termos de rendimento (até ~600 vezes maior) e preservação da integridade das vesículas.
O plasma seminal representa uma "biópsia líquida" ideal para avaliação de biomarcadores da saúde reprodutiva masculina.
Neste artigo, você encontrará:
- O que são exossomos seminais e sua importância na fertilidade
- Comparação detalhada entre SEC e ultracentrifugação
- Protocolo otimizado para isolamento por SEC
- Caracterização física e molecular dos exossomos
- Análise proteômica e aplicações clínicas
- Perguntas frequentes sobre o tema
O Que São Exossomos Seminais e Por Que São Importantes para a Fertilidade
Exossomos seminais são vesículas extracelulares liberadas por diversos órgãos do trato reprodutivo masculino, incluindo próstata, epidídimo e vesículas seminais. Historicamente conhecidos como prostassomos quando associados à origem prostática, esses nanovesículas medem entre 50 e 200 nanômetros e transportam uma carga molecular complexa que inclui miRNA , proteínas, metabólitos e lipídios.
A transferência desse conteúdo molecular aos espermatozoides resulta em modificações funcionais significativas. Estudos demonstram que os exossomos seminais participam ativamente da maturação espermática, potencialização da motilidade, modulação da capacitação e reação acrossômica — etapas fundamentais para a fertilização bem-sucedida. Além disso, exosomes seminais ajudam a modular a resposta imune no trato reprodutivo feminino para favorecer a fertilização (conforme revisões na literatura especializada).
Exossomos seminais protegem os espermatozoides contra ambientes ácidos, inflamatórios e oxidativos, além de estabilizar a membrana plasmática espermática.
Além das funções reprodutivas, pesquisas indicam que essas vesículas possuem atividade antiviral potencial, incluindo ação contra o HIV-1. Essa multifuncionalidade torna os exossomos seminais alvos de interesse tanto para pesquisa básica quanto para aplicações clínicas em medicina reprodutiva.
Métodos de Isolamento de Exossomos: SEC versus Ultracentrifugação
A escolha do método de isolamento impacta diretamente a qualidade, pureza e integridade dos exossomos obtidos. Diversos métodos estão disponíveis, incluindo ultracentrifugação diferencial , cromatografia de exclusão de tamanho , ultrafiltração , precipitação , captura por imunoafinidade e microfluídica.
A ultracentrifugação (UC) representa historicamente o padrão de referência para isolamento de exossomos. O método separa partículas com base em densidade, tamanho e força centrífuga. Contudo, apresenta limitações importantes: processo demorado que pode levar várias horas, necessidade de equipamentos de alto custo com manutenção especializada, e risco de danos estruturais aos exossomos devido às forças centrífugas extremas (100.000 × g ou superiores).
A cromatografia de exclusão de tamanho utiliza um polímero de filtração em gel poroso que permite a eluição de partículas maiores primeiro, seguidas por vesículas menores e proteínas não-exossomais. Esta técnica minimiza a contaminação por proteínas plasmáticas e fornece exossomos de alta pureza com tempo de processamento médio de apenas 20 minutos. O protocolo completo de SEC, incluindo preparação, leva cerca de 1-2 horas, mas a etapa de cromatografia em si é de ~20 minutos, contra várias horas de UC.
A SEC oferece condições de processamento mais suaves que preservam a integridade da membrana exossomal, resultando em vesículas funcionalmente ativas.
Vantagens da Cromatografia de Exclusão de Tamanho
A SEC demonstra superioridade em diversos parâmetros críticos para pesquisa e aplicações clínicas. O método preserva a integridade estrutural dos exossomos por não requerer força centrífuga, resultando em vesículas com membranas intactas e maior atividade biológica. O rendimento obtido é significativamente superior, conforme demonstrado no estudo comparativo que identificou concentrações de 1,1 × 10¹¹ partículas/mL por SEC contra 1,8 × 10⁸ partículas/mL por UC — uma diferença de aproximadamente 600 vezes.
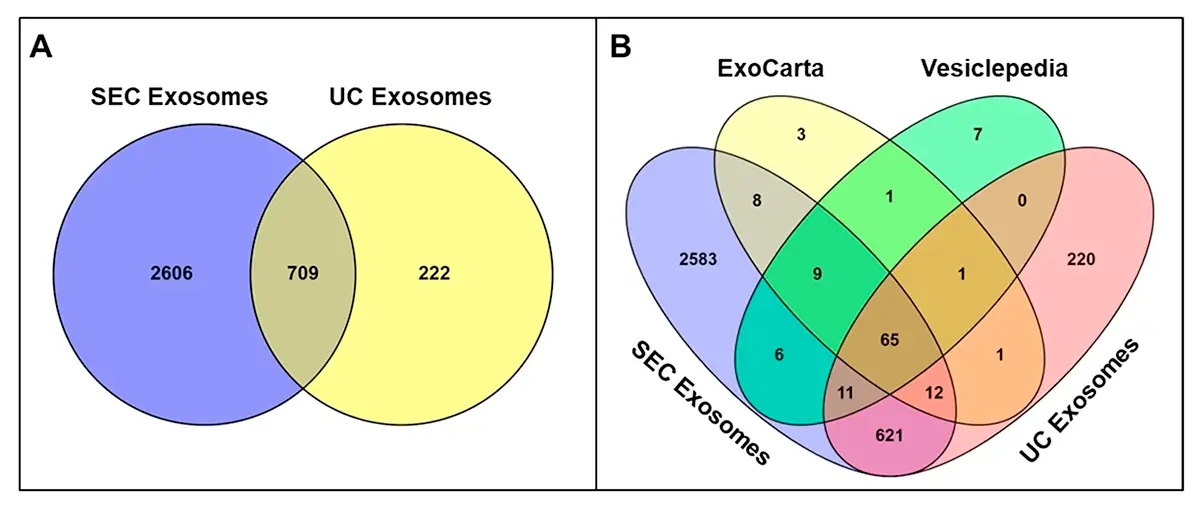
A pureza proteica também favorece a SEC. A análise proteômica revelou 91% de correspondência com o banco de dados Vesiclepedia e 94% com o ExoCarta para exossomos isolados por SEC, comparados a 77% e 79% respectivamente para UC. Adicionalmente, a reprodutibilidade do método e seu custo-benefício favorecem sua implementação em laboratórios de pesquisa e clínicos.
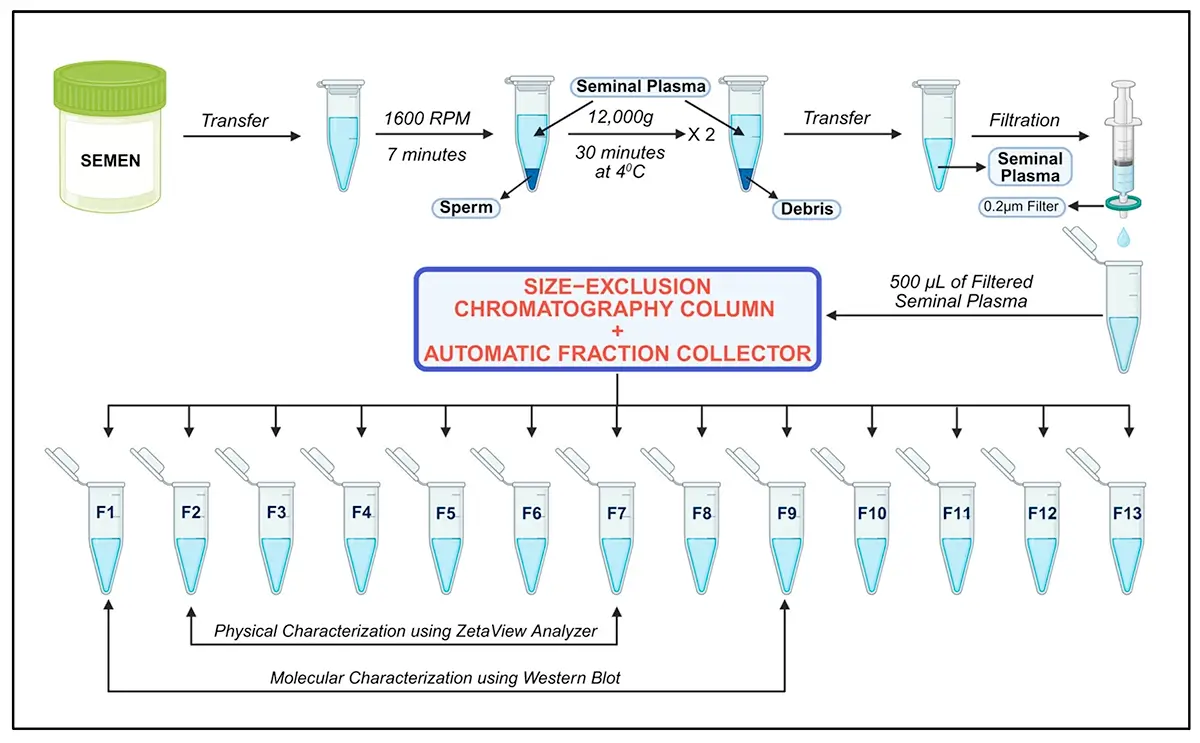
Protocolo Otimizado de SEC para Isolamento de Exossomos do Plasma Seminal
O protocolo descrito utiliza colunas qEV Gen 2-35 nm (Izon Science) acopladas a um coletor automático de frações. O procedimento padronizado permite obtenção consistente de populações homogêneas de exossomos com características físicas e moleculares reprodutíveis.
Preparação da Amostra
O plasma seminal armazenado a -80°C deve ser descongelado a 37°C por 20 minutos. Segue-se centrifugação de alta velocidade a 12.000 × g por 30 minutos a 4°C para remoção de debris residuais. O sobrenadante clarificado passa por filtração sequencial através de membranas de 0,45 µm e 0,22 µm para eliminação de partículas maiores e contaminantes celulares.
Procedimento de Cromatografia
A coluna qEV 35 nm é equilibrada com 17 mL de PBS filtrado (0,22 µm). Um volume de 0,5 mL de plasma seminal filtrado é carregado na coluna. Quando a amostra atinge o frit superior, adiciona-se 8 mL de PBS fresco filtrado. O coletor automático é configurado para coletar 13 frações de 0,4 mL cada, totalizando 2,5 mL de volume de buffer.
As frações F2 e F3 apresentam a maior concentração de exossomos com expressão robusta dos marcadores específicos ALIX e CD63.
Limpeza e Armazenamento da Coluna
Após a fracionação, a coluna é limpa com 8,5 mL de NaOH 0,5 M, seguido de lavagem com 17 mL de PBS filtrado. Este procedimento permite reutilização da coluna para múltiplas amostras, otimizando custos operacionais.
Caracterização Física dos Exossomos Seminais por Análise de Rastreamento de Nanopartículas
A caracterização física dos exossomos isolados foi realizada utilizando o sistema ZetaView PMX-430-Z QUATT (Particle Metrix), equipado com lasers de quatro comprimentos de onda (405/488/520/640 nm). Esta tecnologia de análise de rastreamento de nanopartículas (NTA) permite avaliação simultânea de concentração, distribuição de tamanho e potencial zeta das vesículas.
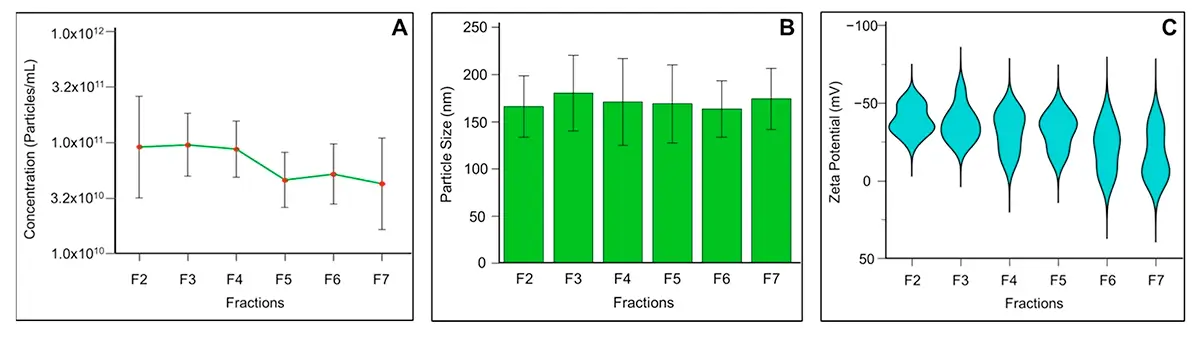
Concentração e Distribuição de Tamanho
As frações F2, F3 e F4 demonstraram as maiores concentrações de exossomos, com valores de 1,5 × 10¹¹, 1,14 × 10¹¹ e 1,02 × 10¹¹ partículas/mL, respectivamente. A distribuição de tamanho revelou uma população homogênea com diâmetro mediano entre 151,8 e 166,4 nm nas frações F2 a F7, consistente com a faixa característica de exossomos.
O protocolo otimizado de SEC produziu exossomos com diâmetro médio de 148,3 nm, valor compatível com exossomos derivados de outros fluidos biológicos utilizando a mesma técnica. A ultracentrifugação resultou em vesículas com diâmetro médio de 174,4 nm, sugerindo possível agregação ou co-purificação de vesículas maiores.
Potencial Zeta e Estabilidade Coloidal
O potencial zeta representa um indicador fundamental da integridade funcional e eficácia biológica dos exossomos. Nanopartículas com potencial zeta entre -20 e +20 mV tendem a agregar. Os exossomos seminais isolados por SEC apresentaram potencial zeta de -32,91 mV, indicando população estável com risco mínimo de agregação.
O potencial zeta negativo (-32,91 mV) dos exossomos isolados por SEC indica alta estabilidade coloidal, essencial para estudos funcionais e aplicações clínicas.
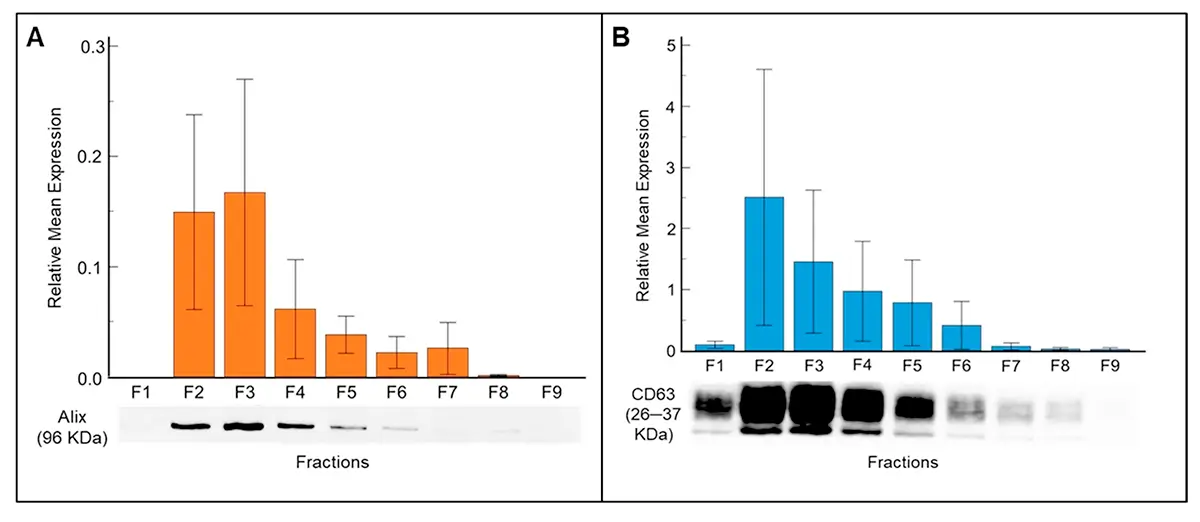
Caracterização Molecular: Marcadores Específicos de Exossomos
A validação molecular dos exossomos isolados foi realizada por Western blot utilizando anticorpos contra marcadores canônicos. A proteína ALIX (96 kDa), um marcador endossomal, foi consistentemente detectada nas frações F2 a F7, com expressão mais intensa nas frações F2 e F3. O CD63 (26 kDa), uma tetraspanina de superfície característica de exossomos, apresentou expressão em todas as frações analisadas.
Análise Proteômica Comparativa: SEC Identifica 3,5 Vezes Mais Proteínas
A análise proteômica por espectrometria de massas revelou diferenças substanciais entre os métodos de isolamento. Exossomos isolados por SEC apresentaram 3.315 proteínas identificadas, enquanto aqueles obtidos por UC continham apenas 931 proteínas. Do total, 709 proteínas foram comuns a ambos os métodos, 2.606 foram exclusivas de SEC e 222 exclusivas de UC.
As proteínas exclusivas identificadas por SEC enriquecem vias como 'splicing de RNA' e 'processamento de mRNA', relevantes para maturação espermática (dados suplementares do estudo original: suplementar ).
Enriquecimento Funcional e Ontologia Gênica
A análise de enriquecimento por Gene Ontology revelou padrões funcionais similares para proteínas de ambos os métodos. Os termos mais enriquecidos incluíram processos biológicos como endocitose, transporte mediado por vesículas e exocitose. Componentes celulares associados a vesículas extracelulares e endossomos também foram altamente representados.
Esta similaridade funcional, combinada com a superioridade quantitativa da SEC, indica que o método preserva a representação biológica dos exossomos enquanto maximiza a cobertura proteômica.
Microscopia Eletrônica de Varredura: Confirmação Morfológica
Imagens de microscopia eletrônica de varredura (MEV) confirmaram a morfologia típica de vesículas extracelulares em amostras de ambos os métodos. As vesículas apresentaram formato esférico característico com diâmetros inferiores a 200 nm, consistentes com as medidas obtidas por NTA.

Aplicações Clínicas e de Pesquisa dos Exossomos Seminais
A otimização do isolamento de exossomos seminais abre perspectivas importantes para aplicações diagnósticas e terapêuticas. O perfil proteômico dessas vesículas oferece informações sobre função espermática, comunicação intercelular e biomarcadores de doenças reprodutivas.
Na medicina reprodutiva, exossomos seminais podem auxiliar no diagnóstico de causas de infertilidade masculina, incluindo astenozoospermia e outras alterações funcionais. A análise de sua carga molecular permite identificação de padrões associados a condições específicas, potencialmente direcionando estratégias terapêuticas personalizadas. Com o avanço de métodos como SEC, os exosomes seminais podem se tornar ferramentas diagnósticas rotineiras, semelhantes ao uso de 'biópsia líquida' em oncologia. Estudos recentes mostram que ncRNAs em EVs seminais estão associados ao sucesso de nascimento vivo em tratamentos de fertilidade ( Non-coding RNAs from seminal plasma extracellular vesicles and success of live birth ).
A custo-efetividade e reprodutibilidade da SEC destacam seu potencial para aplicações diagnósticas em medicina reprodutiva.
Considerações Técnicas e Limitações
Apesar das vantagens demonstradas, algumas considerações técnicas merecem atenção. O volume máximo de amostra para colunas qEV original 35 nm é limitado a 500 µL, o que pode restringir aplicações de alto rendimento. Para volumes maiores, múltiplas corridas ou colunas de maior capacidade podem ser necessárias.
O protocolo combinando filtração 0,22 µm com SEC produziu exossomos com tamanhos entre 162 e 172 nm. A filtração prévia é essencial para prevenir entupimento da coluna e garantir separação eficiente, porém pode resultar em perda de vesículas maiores que poderiam ser de interesse em determinados estudos.
A padronização de métodos de isolamento permanece um desafio no campo de vesículas extracelulares. A demonstração de superioridade da SEC neste estudo contribui para o estabelecimento de protocolos mais reprodutíveis e resultados comparáveis entre laboratórios.
Perguntas Frequentes sobre Isolamento de Exossomos Seminais
O que são exossomos seminais?
Exossomos seminais são vesículas extracelulares de 50-200 nm liberadas por órgãos do trato reprodutivo masculino. Transportam proteínas, miRNA e lipídios que influenciam a função espermática, incluindo motilidade, capacitação e fertilização.
Qual a diferença entre SEC e ultracentrifugação para isolamento de exossomos?
A SEC utiliza filtração em gel para separar partículas por tamanho, preservando a integridade das vesículas. A ultracentrifugação aplica força centrífuga extrema (100.000 × g) que pode danificar os exossomos. Estudos mostram que SEC produz rendimento 600 vezes maior e identifica 3,5 vezes mais proteínas.
Quanto tempo leva o isolamento de exossomos por SEC?
O processamento por SEC leva aproximadamente 20 minutos após a preparação da amostra, significativamente mais rápido que as várias horas necessárias para ultracentrifugação.
Leituras Relacionadas
- Vesículas Extracelulares: Biogênese e Funções Biológicas (ISEV position paper)
- Non-coding RNAs from seminal plasma extracellular vesicles and success of live birth among couples undergoing fertility treatment
- Seminal Plasma Extracellular Vesicles: Key Mediators of Intercellular Communication in Mammalian Reproductive Systems









