O artigo apresenta como técnicas de sorção de vapor, em especial Sorção Dinâmica de Vapor (DVS) e Cromatografia Gasosa Inversa (IGC SEA), podem revelar diferentes graus de desordem em sólidos farmacêuticos, desde cristais perfeitamente ordenados até materiais completamente amorfos.
Ele aborda a importância dessa caracterização para o desenvolvimento de formulações, controle de qualidade e armazenamento de medicamentos, ressaltando que mesmo pequenas frações de material amorfo podem afetar propriedades críticas como solubilidade, estabilidade e mecanicidade.
Por fim, o texto detalha aplicações práticas dessas técnicas, ilustrando como isótermas de sorção, medições de energia superficial e experimentos de transição vítrea fornecem informações valiosas sobre a termodinâmica de fase e a heterogeneidade de superfície.
Neste estudo falaremos sobre:
-
Estados cristalinos e determinação da forma termodinamicamente estável
-
Caracterização de polimorfos por DVS e IGC SEA
-
Formação de hidratos e solvatos e suas isotermas de sorção
-
Quantificação do conteúdo amorfo em materiais farmacêuticos
-
Detecção de transições vítreas induzidas por umidade
-
Monitoramento de cristalização induzida por vapor
-
Estudos de relaxamento energético em partículas micronizadas
-
Análise da heterogeneidade da energia de superfície em pós farmacêuticos
Daniel Burnett, Majid Naderi, Manaswini Acharya e Armando R. Garcia, Surface Measurement Systems Ltd.
A estabilidade termodinâmica dos materiais farmacêuticos afeta todos os níveis da formulação , desenvolvimento de processos e armazenamento . A instabilidade termodinâmica pode variar desde cristais altamente ordenados com diferentes polimorfos ou solvatos até materiais completamente amorfos. Técnicas de sorção de vapor, como Sorção Dinâmica de Vapor e Cromatografia Gasosa Inversa, são ferramentas poderosas para a identificação e caracterização desses materiais.
Introdução
A maioria dos materiais farmacêuticos pode existir em um estado cristalino preferencial, caracterizado por uma estrutura de rede ordenada. No entanto, podem existir várias formas cristalinas diferentes do mesmo material, incluindo polimorfos e/ou formas cristalinas solvatas. Geralmente, haverá uma estrutura cristalina termodinamicamente preferida, com a menor energia. Todas as outras formas são consideradas metaestáveis e, eventualmente, irão relaxar para a forma mais estável. Porém, os tempos dessas transições podem ser longos o suficiente nas condições típicas de armazenamento e processamento para que as formas metaestáveis sejam usadas no desenvolvimento farmacêutico.
Além disso, durante o processamento de sólidos farmacêuticos (por exemplo, cristalização, moagem, secagem por pulverização, compactação de comprimidos, granulação úmida e liofilização), vários graus de desordem na forma de defeitos cristalinos e/ou regiões amorfas podem ser gerados. Em casos extremos, o material pode ser completamente amorfo, onde não há mais qualquer ordem estrutural de longo alcance. Materiais amorfos em formulações farmacêuticas geram problemas complexos e desafiadores relacionados ao desempenho, processamento e armazenamento desses produtos [1].
A presença de materiais amorfos pode ser desejada ou indesejada, dependendo das propriedades únicas desejadas ou indesejadas do estado amorfo. Mesmo níveis relativamente baixos de material amorfo (<10%) podem ter um impacto prejudicial na estabilidade e na fabricabilidade do produto farmacêutico formulado. Materiais desordenados são inerentemente metaestáveis e, quando submetidos a energia térmica ou mecânica, tendem a reverter para uma forma cristalina mais termodinamicamente estável.
Por essas razões, investigar o nível de desordem ou o estado termodinâmico dos materiais farmacêuticos é crítico para sua formulação, armazenamento e processamento.
Este artigo de visão geral destaca como técnicas de sorção de vapor podem ser usadas para estudar sólidos farmacêuticos, desde o estado cristalino de menor energia, passando por polimorfos e solvatos de energia mais alta, até sítios de defeitos e materiais completamente amorfos. Sorção Dinâmica de Vapor (DVS) e Cromatografia Gasosa Inversa (IGC SEA) são técnicas bem estabelecidas usadas para a determinação das propriedades superficiais e de massa de pós, fibras e filmes. O objetivo deste artigo é focar nas aplicações de estas técnicas conforme se relacionam à estabilidade termodinâmica em materiais farmacêuticos.
Método
Métodos gravimétricos de sorção de vapor têm sido amplamente usados para estudar a interação da água com materiais farmacêuticos [2,3]. DVS é um método bem estabelecido para a determinação de isotermas de sorção de vapor. O DVS mede a variação da massa da amostra enquanto o ambiente de vapor ao redor da amostra é alterado de maneira controlada. Um aumento na massa está tipicamente associado à sorção de vapor, enquanto uma diminuição é devida à dessorção de vapor. A concentração de vapor ao redor da amostra é controlada pela mistura de fluxos de gás portador saturado e seco, usando controladores eletrônicos de fluxo de massa.
Os princípios básicos do IGC SEA são muito simples, sendo o inverso de um experimento convencional de cromatografia gasosa (GC). Contudo, ao contrário da GC analítica, o IGC SEA é uma técnica de caracterização físico-química, e não uma técnica analítica. Para realizar um experimento de IGC SEA, uma coluna é inicialmente preenchida ou revestida com um material sólido de interesse, tipicamente um pó, fibra, filme ou revestimento. Uma pulsação ou concentração constante de uma molécula sonda conhecida de vapor ou gás é então injetada na coluna em uma taxa fixa de fluxo de gás portador, e o comportamento de retenção da pulsação ou frente de concentração é medido por um detector. Uma série de medições IGC SEA com diferentes moléculas sonda em fase gasosa ou vapor permite o acesso a uma ampla gama de propriedades físico-químicas da amostra sólida.
O parâmetro fundamental a partir do qual a maioria das propriedades físico-químicas são derivadas é conhecido como volume de retenção, VN, uma medida da intensidade da interação de uma molécula sonda de vapor com a amostra sólida. A partir desse volume de retenção, derivam-se a energia superficial, o parâmetro de solubilidade e outras propriedades físicas de um material farmacêutico. Várias revisões detalhadas sobre a teoria e aplicação do IGC SEA podem ser encontradas na literatura aberta [4,5,6,7].
Materiais Cristalinos
A forma mais termodinamicamente estável de um sólido farmacêutico será o estado cristalino de menor energia. Este material terá o menor valor de energia livre comparado às formas menos estáveis. Além disso, a energia livre superficial será independente apenas do tamanho das partículas. Isso é ilustrado na Figura 1 para a α-lactose monoidratada cristalina. Cristais peneirados em diferentes frações de tamanho de partículas apresentaram valores idênticos de energia superficial dispersiva. Portanto, quaisquer mudanças na energia superficial serão devido a uma alteração na química da superfície ou na orientação dos grupos superficiais, e não apenas ao tamanho das partículas.
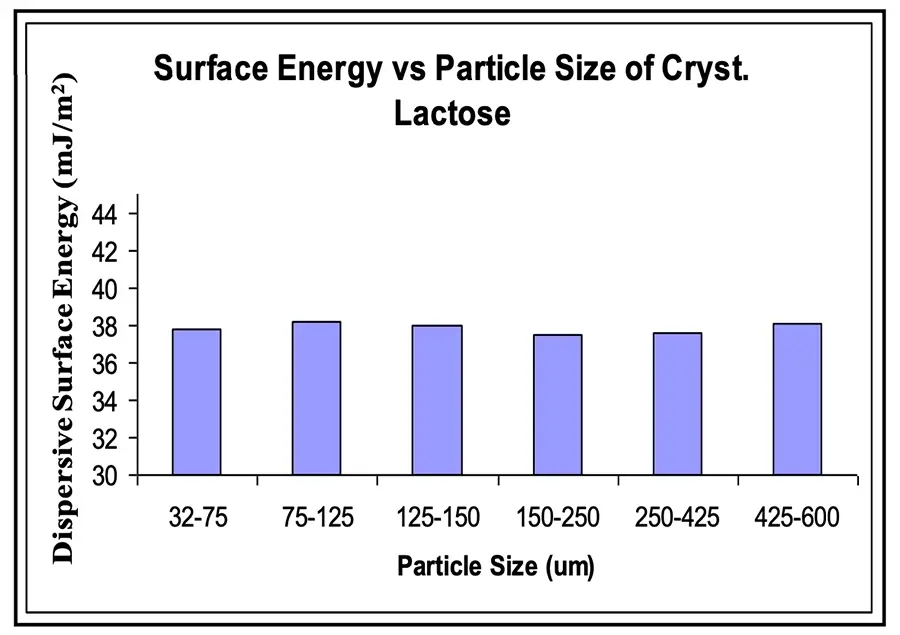
Figura 1: Valores da energia superficial dispersiva para cristais de monohidrato de α-lactose em diferentes frações de tamanho de partículas.
Polimorfos
Como mencionado anteriormente, a maioria dos materiais terá uma configuração cristalina termodinamicamente preferida. No entanto, muitos sólidos farmacêuticos podem apresentar polimorfismo, que é a capacidade de uma substância existir em duas ou mais fases cristalinas que possuem diferentes arranjos da rede cristalina [8]. Cada polimorfo estará associado a uma energia diferente, sendo uma configuração mais estável. As formas menos estáveis irão, em última instância, relaxar para a forma mais estável, mas essas transições podem apresentar barreiras de ativação bastante altas nas condições típicas de armazenamento e processamento, levando à existência de polimorfos metaestáveis [9]. Diferentes polimorfos podem apresentar propriedades físicas e mecânicas bastante distintas, incluindo densidade, higroscopicidade, solubilidade, taxa de dissolução, dureza e compactabilidade. Por isso, a caracterização das diferentes formas polimórficas é essencial para o desenvolvimento bem-sucedido e para a estabilidade dos produtos farmacêuticos.
Tanto a Cromatografia Gasosa Inversa Superficial (IGC SEA) quanto a Sorção Gravimétrica de Vapor (DVS) têm sido empregadas com sucesso na caracterização de polimorfos. Por exemplo, o DVS demonstrou que quatro polimorfos anidros de Neotame apresentavam propriedades únicas de sorção de água. Em particular, os quatro polimorfos mostraram uma clara tendência na facilidade de conversão para a forma monohidratada [10]. Além disso, diferentes formas polimórficas de Salicaína foram facilmente diferenciadas e identificadas por meio de seus isotermais de sorção de água exclusivos [11]. Outros estudos gravimétricos de sorção de vapor em polimorfos também revelaram diferenças evidentes no comportamento de sorção de umidade [12,13].
As diferentes formas polimórficas frequentemente apresentam distintos valores de energia livre, tornando as medições da energia livre superficial por IGC SEA uma técnica ideal para seu estudo. Por exemplo, IGC SEA foi utilizada para estudar dois polimorfos de Xemilofiban, onde o polimorfo A apresentou uma energia superficial dispersiva de 49,8 mJ/m² e o polimorfo B, 42,9 mJ/m² [14]. Sabe-se que o polimorfo B é a forma termodinamicamente mais estável, o que está associado a um menor valor de energia livre. Portanto, o valor mais baixo da energia superficial foi consistente (embora não necessariamente determinante) com a forma cristalina mais estável. Após moagem e exposição do polimorfo A a condições de alta umidade, não houve relaxamento para o polimorfo mais estável, indicando que ele é cineticamente estável (ver Tabela 1).
Adicionalmente, as propriedades de energia superficial e ácido/base de diferentes polimorfos de Salmeterol Xinafoato foram estudadas por IGC SEA [15,16,17]. O polimorfo metastável da Forma II apresentou energia superficial, entropia e superfície mais polar superiores ao polimorfo estável da Forma I [15].
Tabela 1. Valores da energia superficial dispersiva para dois polimorfos de Xemilofiban a 30 °C.
| Amostra | Energia Superficial Dispersiva (mJ/m²) |
|---|---|
| Polimorfo B | 42,9 |
| Polimorfo A | 49,8 |
| Polimorfo A (moído) | 50,4 |
| Polimorfo A (moído e umidificado) | 50,6 |
Hidratos e Solvatos
Hidratos e solvatos representam outra importante classificação de materiais cristalinos farmacêuticos. Aproximadamente um terço dos materiais orgânicos são capazes de formar hidratos ou solvatos [18]. Solvatos não são tecnicamente polimorfos, pois consistem em cristais com diferentes números de moléculas de solvente, enquanto polimorfos são diferentes estruturas da mesma molécula. O estado de solvatação depende tanto da temperatura quanto da pressão do vapor do solvente acima do sólido. Assim como os polimorfos de energia mais elevada, materiais solvatos também podem ser metastáveis sob condições apropriadas.
O estado de solvatação de um material pode influenciar várias propriedades, incluindo a estabilidade física e química. A estabilidade físico-química dos solvatos é particularmente relevante, pois durante a dessecação eles podem se converter em formas amorfas ou se tornar quimicamente lábeis [19]. Além disso, diferentes formas de solvatos podem afetar a taxa de dissolução, a fluidez e a compactabilidade do material. Esses fatores impactam toda a cadeia do processo de desenvolvimento farmacêutico, desde a pré-formulação até a fabricação, embalagem e armazenamento.
A técnica de Sorção Gravimétrica de Vapor (DVS) é amplamente utilizada para investigar a formação de solvatos, em particular hidratos. A conversão do estado não solvato para o estado solvato corresponde a uma transformação de fase de primeira ordem. Seja formada a partir da fase líquida ou da fase vapor, ambas as transições de solvatação e desolvatação são termodinamicamente equivalentes. Quando ambos os processos ocorrem em condições de equilíbrio, a transição de solvatação-desolvatação deve acontecer nas mesmas atividades do solvente, tanto na fase líquida quanto na fase vapor [20].
Portanto, a formação de solvatos medida por técnicas de sorção de vapor indica onde transições semelhantes ocorreriam na fase líquida. Contudo, a cinética dessas transições pode ser significativamente diferente na fase vapor em comparação à fase líquida.
A formação estequiométrica de hidratos e solvatos por DVS é explicada em detalhes nas referências 21 e 22, respectivamente. Se o peso molecular do material anidro for conhecido, é possível determinar a estequiometria do solvato.
Para ilustrar, a Figura 2 apresenta as isotermas de sorção de acetona do carbamazepine anidro. Abaixo de 85% P/Po, a amostra não adsorve quantidade apreciável de vapor de acetona. Acima desse ponto, a amostra absorve 23,7% do seu peso seco em vapor de acetona. Isso se deve à formação de um solvato 1:1 com acetona.
Durante a dessorção, a molécula de acetona solvata não é removida até que a amostra seja exposta a uma concentração de vapor de acetona abaixo de 10% P/Po. A histerese em formato de ‘quadrado’ é típica para solvatos estequiométricos formados durante um experimento de DVS. Mais detalhes sobre a solvatação do carbamazepine induzida pelo vapor de acetona podem ser encontrados no artigo [23].
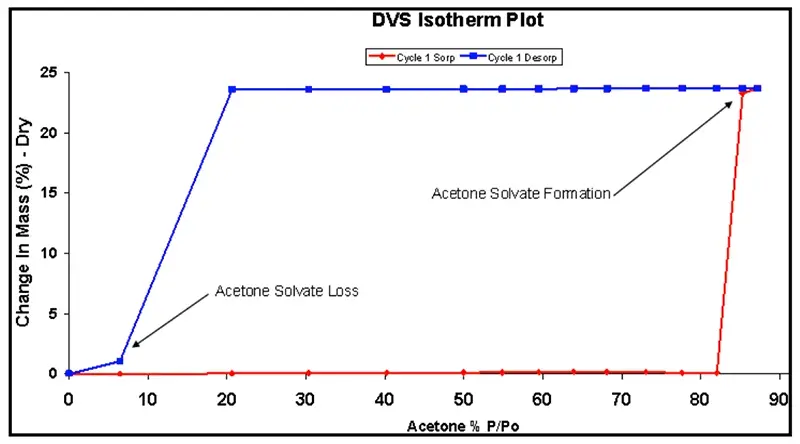
Figura 2: Isotermas de sorção (vermelho) e dessorção (azul) de vapor de acetona para carbamazepina a 25 °C.
Hidratos não estequiométricos podem existir em configurações de canal, gaiola e camada. O DVS também já foi utilizado anteriormente para estudar hidratos em canal [24]. Neste estudo, tanto a forma estequiométrica trihidrato quanto a forma de hidrato em canal foram claramente identificadas por suas respectivas isotermas de sorção de água.
Métodos gravimétricos de sorção de vapor também têm sido usados para estudar o efeito de excipientes nas transformações de fase hidrato-anidro [25]. Além disso, esses métodos têm a vantagem adicional de permitir a investigação da cinética de desidratação [26, 27] e dessorção [23].
Uma área final de caracterização na formação de hidratos/solvatos de materiais farmacêuticos é o uso combinado do DVS com espectroscopia vibracional in situ. À medida que a umidade é absorvida pela amostra, a estrutura intermolecular e as forças dentro dela se adaptam para acomodar as moléculas de água. Isso leva a mudanças nas características vibracionais moleculares da amostra, que podem ser monitoradas por alterações no espectro Raman [28] ou no espectro de Infravermelho Próximo (Near-IR) [29].
Para ilustrar, a Figura 3 mostra os espectros Raman para o Nedocromil sódico a 13% e 15% de umidade relativa (RH) [28]. Os dados de sorção de água obtidos pelo DVS nessa faixa indicam a absorção de duas moléculas de água. Os espectros Raman confirmam a transição do estado monohidrato para o tri-hidrato. Conforme o composto muda seu estado de hidratação, modificações substanciais podem ocorrer em propriedades farmacêuticas importantes, como a solubilidade e biodisponibilidade do fármaco.
Além disso, a hibridização da espectroscopia Near-IR com DVS foi capaz de correlacionar mudanças no pico –OH com alterações no estado hidratado do cristalino da rafinose [29]. A amostra começou na forma pentahidratada, mas durante a secagem as formas penta-, tetra-, tri- e di-hidratada puderam ser identificadas pelos espectros Near-IR.
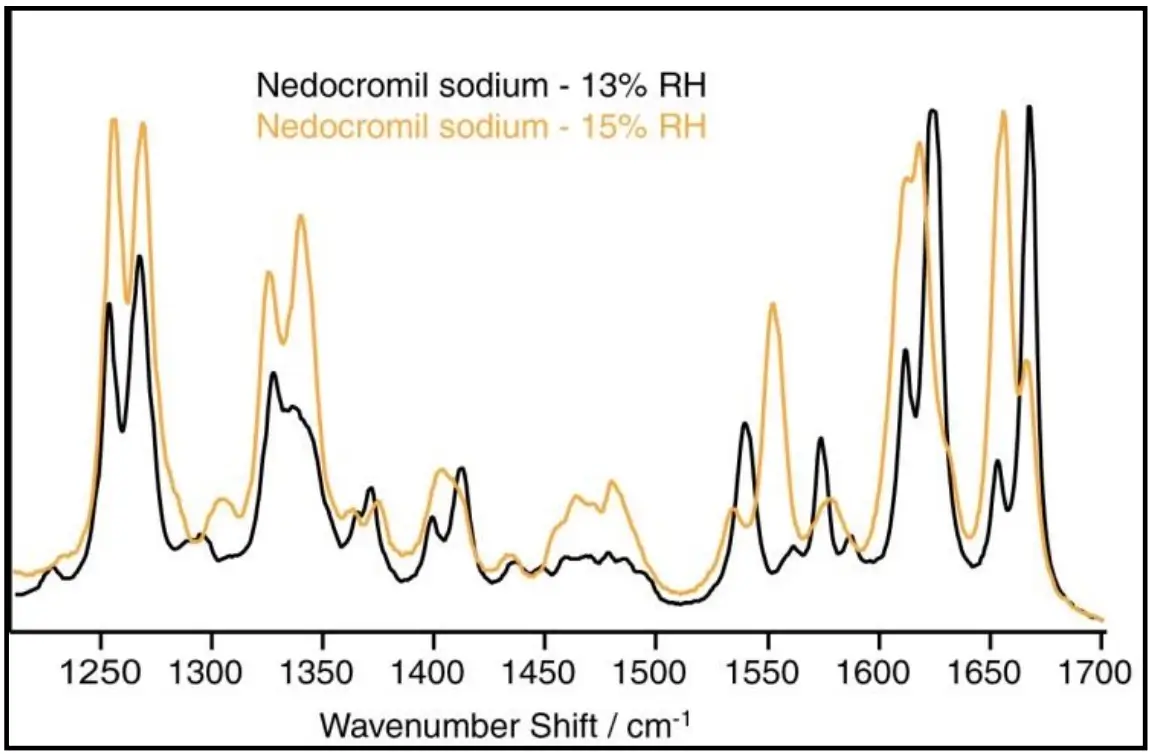
Figura 3: Espectros de nedocromil sódico em 13% e 15% de umidade relativa.
Natureza Anisotrópica dos Cristais
Materiais cristalinos podem ser energeticamente anisotrópicos, o que significa que a química superficial não é homogênea, e diferentes planos cristalinos podem apresentar química distinta. Experimentos de molhabilidade em cristais macroscópicos demonstraram claramente diferenças na energia superficial entre diferentes planos cristalinos de princípios ativos farmacêuticos [30,31].
Os hábitos dos cristais únicos macroscópicos de paracetamol, crescidos tanto a partir de metanol quanto de acetona, correspondem aos relatados na literatura, com as principais faces (201), (001), (011) e (110). Além disso, experimentos de IGC SEA em paracetamol moído indicaram que a moagem expõe preferencialmente a face (010) dos cristais da forma I do paracetamol, enquanto que nas amostras não moídas a face (201) é predominante [32].
Isso é ilustrado na Tabela 2 (dados obtidos da Referência 32), onde há pouca diferença nos valores da energia superficial dispersiva para os cristais não moídos, mas os cristais menores e moídos apresentam energia superficial dispersiva significativamente maior. Por exemplo, em frações de tamanho de partículas entre 75 e 125 µm, as amostras moídas têm uma energia superficial dispersiva de 39,9 mJ/m², enquanto o valor para as não moídas é apenas 31,26 mJ/m². Isso ocorre devido à exposição da face cristalina (010) pela moagem [30,32].
Mudanças na molhabilidade após a moagem podem, por fim, afetar o comportamento de granulação. Portanto, mesmo para materiais cristalinos, é importante tratá-los como materiais energeticamente heterogêneos, e sua energia superficial pode não ser adequadamente descrita por um único valor.
Experimentos de IGC SEA com concentração finita permitem a determinação das distribuições de energia superficial, que descrevem com mais precisão a energia superficial anisotrópica para materiais reais. As distribuições de energia superficial serão discutidas em seção posterior.
Tabela 2. Valores da Energia Superficial Dispersiva para Cristais de Paracetamol não Moídos e Moídos Crescidos a partir de Solução de Acetona em Diferentes Frações de Tamanho de Partícula.
| Tamanho de Partícula (µm) | 32-75 | 75-125 | 125-150 | 150-250 | 250-425 | 425-600 | 600-725 |
|---|---|---|---|---|---|---|---|
| Não Moído | - | 31,26 | 30,67 | 30,67 | 31,20 | 32,32 | 32,91 |
| Moído | 41,0 | 39,3 | 39,6 | 37,8 | 37,6 | 34,0 | - |
Defeitos Cristalinos
Materiais cristalinos raramente são perfeitos. De fato, mesmo cristais únicos apresentam uma estrutura composta por limites, vacâncias, saliências (kinks) e outros sítios defeituosos. Além disso, etapas de processamento, como moagem, spray-drying, liofilização, granulação e compactação, podem induzir variados graus de desordem nos materiais cristalinos.
Defeitos cristalinos podem apresentar comportamento diferente do material amorfo, como observado em um estudo com Griseofulvina [33]. Devido à alta sensibilidade a mudanças superficiais sutis, o IGC SEA é uma técnica ideal para estudar desordens induzidas por processos.
Por exemplo, IGC SEA tem sido empregado para estudar as mudanças nas propriedades superficiais causadas pela moagem [32,34,35]. Em um estudo, a superfície do Cefditoren Pivoxil tornou-se progressivamente mais básica à medida que as condições de moagem se tornaram mais agressivas. Os autores atribuíram essa mudança na química superficial à exposição de grupos carbonila, que inicialmente estavam abaixo da superfície no material cristalino inicial [34].
Se a desordem aumenta por processamento ou criação intencional, os materiais farmacêuticos podem tornar-se (parcialmente) amorfos.
Materiais Amorfo ou Parcialmente Amorfo
Como mencionado anteriormente, seja induzido intencionalmente ou não, a presença da fase amorfa pode trazer desafios únicos na formulação, processamento e armazenamento desses materiais.
As próximas seções destacarão como o IGC SEA e o DVS têm sido empregados para identificar e caracterizar a fase amorfa.
Identificação da Fase Amorfa
O IGC SEA tem sido utilizado em diversos artigos para identificar diferenças claras entre as fases amorfa e cristalina [34,35,36]. O IGC SEA não apenas é sensível à criação de materiais amorfos, mas também pode distinguir diferenças na energia superficial de materiais amorfos obtidos por diferentes rotas de processamento.
A Tabela 3 apresenta os valores da energia superficial dispersiva para α-lactose monoidratada cristalina e lactose (parcialmente) amorfa produzida por diferentes processos. A α-lactose monoidratada cristalina apresenta um valor de energia superficial dispersiva muito menor (37,6 mJ/m²) quando comparada às amostras amorfas de lactose.
No entanto, os valores da energia superficial dispersiva para as amostras amorfas variaram de 43,2 mJ/m² para a lactose spray-dryed (liofilizada por atomização) até 50,7 mJ/m² para a lactose liofilizada por supercrítico. Os valores das amostras spray-dryed, liofilizadas e liofilizadas por supercrítico na Tabela 3 foram medidos em amostras com conteúdo amorfo semelhante, de modo que as diferenças não podem ser explicadas por diferentes graus de cristalinidade, mas sim por diferenças na química ativa da superfície.
Tabela 3. Valores da Energia Superficial Dispersiva para Lactose Amorfa Obtida por Diferentes Rotas de Processamento.
| Amostra | Energia Superficial Dispersiva (mJ/m²) |
|---|---|
| α-lactose monoidratada cristalina | 37,6 |
| Lactose spray-dried | 43,2 |
| Lactose liofilizada (freeze-dried) | 48,1 |
| Lactose liofilizada por supercrítico | 50,7 |
O DVS (Dynamic Vapor Sorption) também tem sido utilizado com sucesso para identificar diferenças entre as fases cristalina e amorfa. Para ilustrar, a cinética de hidratação da teofilina anidra estudada por DVS foi muito diferente para as fases cristalina e amorfa [37].
Utilizando DVS combinado com espectroscopia Raman in situ, foi demonstrado que para o cromoglicato dissódico tanto a cristalinidade quanto o teor de água diminuem gradualmente à medida que a umidade relativa do ambiente é reduzida durante a desidratação, sugerindo que a transição entre as formas cristalina e amorfa não pode ser definida com precisão [28].
Além disso, o DVS em combinação com espectroscopia no infravermelho próximo (near-IR) tem sido utilizado para identificar diferenças entre a rafinose cristalina e amorfa [29].
Quantificação de Conteúdos Amorfo Abaixo de 5%
Existem diversas técnicas disponíveis para quantificar níveis moderados a altos de material amorfo em pós. Algumas dessas técnicas incluem: calorimetria exploratória diferencial (DSC), densidade, difração de raios X em pós, espectroscopia de corrente estimulada termicamente, calorimetria em solução, FT-Raman, infravermelho próximo (Near IR) e DSC modulada.
No entanto, poucas técnicas são capazes de quantificar conteúdos amorfos abaixo de 1%. Essas técnicas incluem: RMN de estado sólido, microcalorimetria de fluxo e difração de raios X em pó com feixe paralelo.
Uma das técnicas mais sensíveis e reprodutíveis é a sorção gravimétrica de vapor.
Na literatura, existem vários métodos usando técnicas de sorção gravimétrica para quantificar conteúdos amorfos [38,39,40,41,42]. A maioria desses métodos baseia-se no fato de que a fase amorfa absorve mais vapor do que a fase cristalina. Materiais amorfos geralmente possuem maior área superficial e afinidade por vapor do que seus equivalentes cristalinos.
Para métodos de sorção de vapor, normalmente é necessária uma calibração com conteúdos amorfos conhecidos. Em seguida, a absorção de vapor no equilíbrio em determinada concentração de vapor é plotada em função do conteúdo amorfo conhecido, gerando uma curva de calibração à qual conteúdos amorfos desconhecidos podem ser comparados.
Devido às mudanças no estado cristalino induzidas pela água (solvatação, conversão de polimorfos, etc.), recomenda-se o uso de vapor orgânico não polar para materiais hidrofóbicos.
Para ilustrar, a Figura 4 apresenta as isotermas de sorção de vapor de octano (a) e a curva de calibração (b) para amostras de lactose com conteúdos amorfos variados. As margens de erro em Figura 4b baseiam-se no primeiro desvio padrão de medições repetidas (n=3).
Padrões amorfos foram criados por meio da mistura física de lactose 100% amorfa com lactose 100% cristalina. A curva de calibração resultante e o coeficiente de correlação (R² = 0,9994) indicam que conteúdos amorfos abaixo de 0,5% podem ser detectados com uma precisão de ± 0,3%. Outros métodos de sorção de vapor também conseguiram quantificar conteúdos amorfos abaixo de 1% com precisões semelhantes [38,39,40,41].

Figura 4. Isotermas de sorção de vapor de octano (a) e curva de calibração resultante (b) para amostras de lactose com diferentes frações amorfas.
Transição do Estado Vítreo para o Estado Borrachoso
Quando um material amorfo atravessa a transição vítrea, ele frequentemente se transforma de um material vítreo, duro e quebradiço, para um estado menos viscoso, semelhante a uma “borracha” [43]. Além disso, ocorre uma mudança na mobilidade molecular dos compostos amorfos durante a transição vítrea [44].
Acima da temperatura de transição vítrea, a mobilidade molecular aumenta, evidenciada pela diminuição da viscosidade e pelo aumento das propriedades de fluxo. A temperatura geralmente induz essa transformação em uma temperatura característica ou intervalo de temperatura (ou seja, Tg).
O IGC SEA pode ser utilizado para determinar temperaturas de transição vítrea em materiais farmacêuticos [45,46,47,48]. Isso é normalmente observado por uma mudança dramática no volume de retenção à medida que a amostra atravessa a transição vítrea.
Abaixo da Tg, o volume de retenção é dominado pela adsorção na superfície, enquanto acima da Tg, predomina a absorção no volume (bulk absorption), levando a volumes de retenção maiores.
O IGC SEA possui a vantagem única de quantificar a transição vítrea em função da umidade relativa de fundo. Estudando as transições vítreas sob diferentes condições de umidade, pode-se investigar o efeito plastificante da água.
Tabela 4. Temperatura de transição vítrea da α-D-maltose em diferentes condições de umidade relativa, medida por IGC SEA.
| Umidade Relativa (%) | Temperatura de Transição Vítrea |
|---|---|
| 0 | 88,5 °C (361,6 K) |
| 5 | 75,5 °C (348,6 K) |
| 10 | 65,7 °C (338,8 K) |
| 15 | 59,4 °C (332,5 K) |
Como ilustrado acima, a água é um plastificante comum; assim, o teor de água em alimentos amorfos, polímeros e materiais farmacêuticos pode reduzir significativamente a temperatura de transição vítrea.
O DVS pode ser usado para estudar transições vítreas induzidas pela umidade. Se a umidade ao redor de um material amorfo for aumentada linearmente de 0% de umidade relativa (UR) até um valor acima da transição vítrea induzida pelo vapor de água, então uma mudança nas características de sorção de vapor será evidente.
Abaixo da transição vítrea, a sorção de água normalmente é limitada à adsorção superficial. Conforme o material atravessa a transição vítrea, a mobilidade molecular aumenta, permitindo a absorção de água em volume.
Portanto, a mudança nas características de sorção pode ser usada como uma medida da transição vítrea. Acima da transição vítrea, alguns materiais amorfos relaxam para seu estado mais estável, o cristalino.
Como mencionado anteriormente, o material amorfo geralmente apresenta maior capacidade de sorção de vapor de água do que o material cristalino, devido ao aumento do espaço vazio, energia livre e/ou área superficial. Quando o material passa da fase amorfa para a cristalina, a capacidade de sorção de água geralmente diminui drasticamente. Isso resulta em uma perda de massa total, pois o excesso de água é desorvido durante a cristalização.
Essa perda de massa durante a transição pode ser usada para identificar a umidade específica em que a transição vítrea e a cristalização ocorrem.
Para ilustrar, a Figura 5 apresenta um experimento de aumento gradual da umidade a uma taxa de 6% UR/hora para uma amostra de lactose amorfa. Abaixo da transição vítrea, a sorção de água é dominada pela adsorção na superfície. Acima da transição vítrea, a sorção de água é dominada pela absorção em volume.
O ponto de transição entre esses dois regimes é considerado a transição vítrea induzida pelo vapor. Na Figura 5, isso ocorre em torno de 40% UR. Se os valores forem extrapolados para uma taxa de aumento de umidade de 0% UR/hora, obtém-se um valor de 30% UR.
Essa técnica já foi utilizada anteriormente em diferentes materiais, com resultados semelhantes aos obtidos por DSC e IGC SEA [49].
À medida que a umidade aumenta e o vapor d’água plastifica ainda mais a amostra, alguns materiais de baixo peso molecular podem relaxar para o estado cristalino. Isso é observado na Figura 5 pela perda abrupta de massa acima de 60% UR.
Em uma taxa extrapolada de aumento de 0% UR/hora, obtém-se o valor de 58% UR para a umidade de cristalização. Novamente, isso apresenta boa correlação com outros estudos de vapor em lactose amorfa [49].
As mudanças físicas inferidas a partir dos dados gravimétricos podem ser ainda melhor evidenciadas por imagens microscópicas in situ coletadas durante o experimento.
A Figura 6 mostra imagens com aumento de 100x de lactose amorfa em 0% (A), 50% (B), 60% (C) e 90% UR (D).
Em 50% UR, a amostra já está claramente alterada para a forma borrachosa devido à transição vítrea induzida pela umidade. Em 60% UR, a amostra começa a cristalizar, e em 90% UR a cristalização da lactose amorfa é evidente pelo aumento da opacidade da imagem.
Quando combinadas com a mudança de massa observada na Figura 5, as imagens da Figura 6 identificam claramente diferentes mudanças de fase induzidas pela umidade.
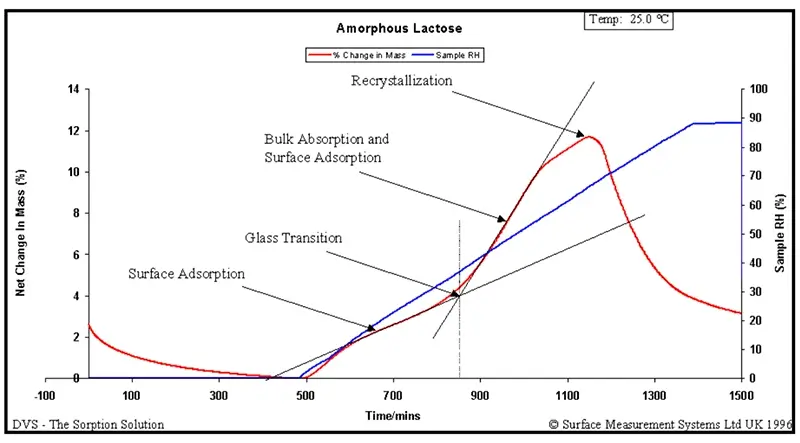
Figura 5. Experimento de aumento gradual da umidade para lactose amorfa mostrando a transição vítrea e a cristalização induzidas pela umidade.
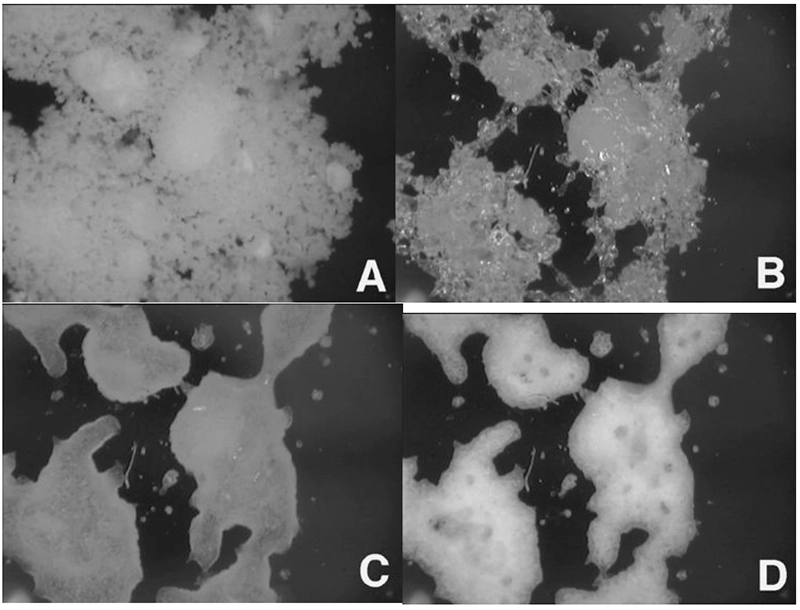
Figura 6. Imagens in situ coletadas em lactose amorfa a 0% (A), 50% (B), 60% (C) e 90% UR (D).
Cristalização Induzida por Vapor
Como mostrado acima, quando um material amorfo sofre cristalização induzida por vapor, geralmente ocorre uma perda abrupta de massa devido à menor área superficial, energia superficial e/ou espaços vazios na fase cristalina (ou seja, maior densidade).
Essa perda de massa pode ser usada para monitorar a reação de cristalização.
A Figura 7 apresenta o comportamento de cristalização induzida por umidade para lactose amorfa exposta a 55% UR a 25 °C.
A característica distinta de perda de massa observada por volta de 900 minutos corresponde à cristalização da lactose amorfa. A cristalização está completa por volta de 1200 minutos, conforme mostrado na Figura 7.
Se experimentos semelhantes ao apresentado na Figura 7 forem realizados sob diferentes condições de temperatura ou solvente, o mecanismo de cristalização poderá ser elucidado. Dessa forma, o comportamento de cristalização pode ser previsto para uma faixa mais ampla de concentrações de vapor e condições de temperatura.
A Figura 8 apresenta o comportamento de cristalização de uma amostra de lactose amorfa a 51% UR e diferentes temperaturas. A escala foi normalizada para que o tempo zero corresponda ao início da cristalização. Além disso, o eixo y foi normalizado para a fração cristalizada (1 = completamente amorfa e 0 = completamente cristalina).
Ao processar esses dados com um pacote de modelagem mecanística, a análise indicou um mecanismo composto por duas reações concorrentes em duas etapas.
Detalhes completos sobre o mecanismo de cristalização podem ser encontrados na Referência [50].
Após a determinação do mecanismo, é possível prever o comportamento da cristalização da fase amorfa para uma ampla variedade de condições de armazenamento, processamento e embalagem.
Essa abordagem também pode ser aplicada para estudar outras transições em estado sólido, como desidratação, hidratação ou solvatação [51,52,53].
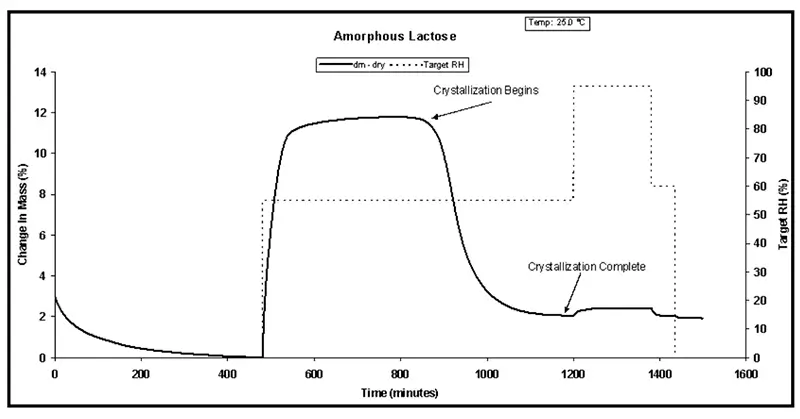
Figura 7. Cristalização de lactose amorfa a 55% UR e 25 °C.
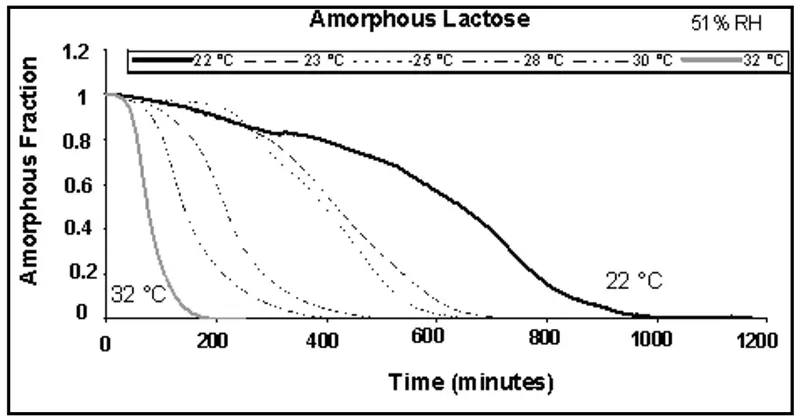
Figura 8. Cristalização de lactose induzida por umidade a 51% UR entre 22 e 32 °C.
Relaxamento Energético
Substâncias farmacêuticas destinadas à administração pulmonar frequentemente são micronizadas para reduzir o tamanho das partículas à faixa respirável, abaixo de 6 µm. Esses processos de alta energia geralmente alteram a morfologia da superfície, aumentam os sítios de defeito ou diminuem a cristalinidade.
É fundamental entender como esses sítios de alta energia se relaxam ao longo do tempo sob diferentes condições de armazenamento ou exposição.
Um estudo recente realizado pela SMS monitorou a química da superfície de uma amostra de budesonida micronizada após exposição a 52% de umidade relativa e 25 °C, em função do tempo de exposição, utilizando a técnica IGC SEA.
Após exposição a essas condições, a energia superficial dispersiva manteve-se relativamente constante até cerca de 30 dias, quando apresentou uma queda moderada (Figura 9a).
Em contraste, a basicidade superficial diminuiu (ou a acidez superficial aumentou) drasticamente com o aumento do tempo de exposição a 52% UR, conforme ilustrado pela razão Ka/Kb na Figura 9b.
Isso sugere uma reorientação dos grupos polares na superfície, o que pode, portanto, afetar o balanço das forças de adesão e coesão da budesonida em formulações DPI binárias típicas.
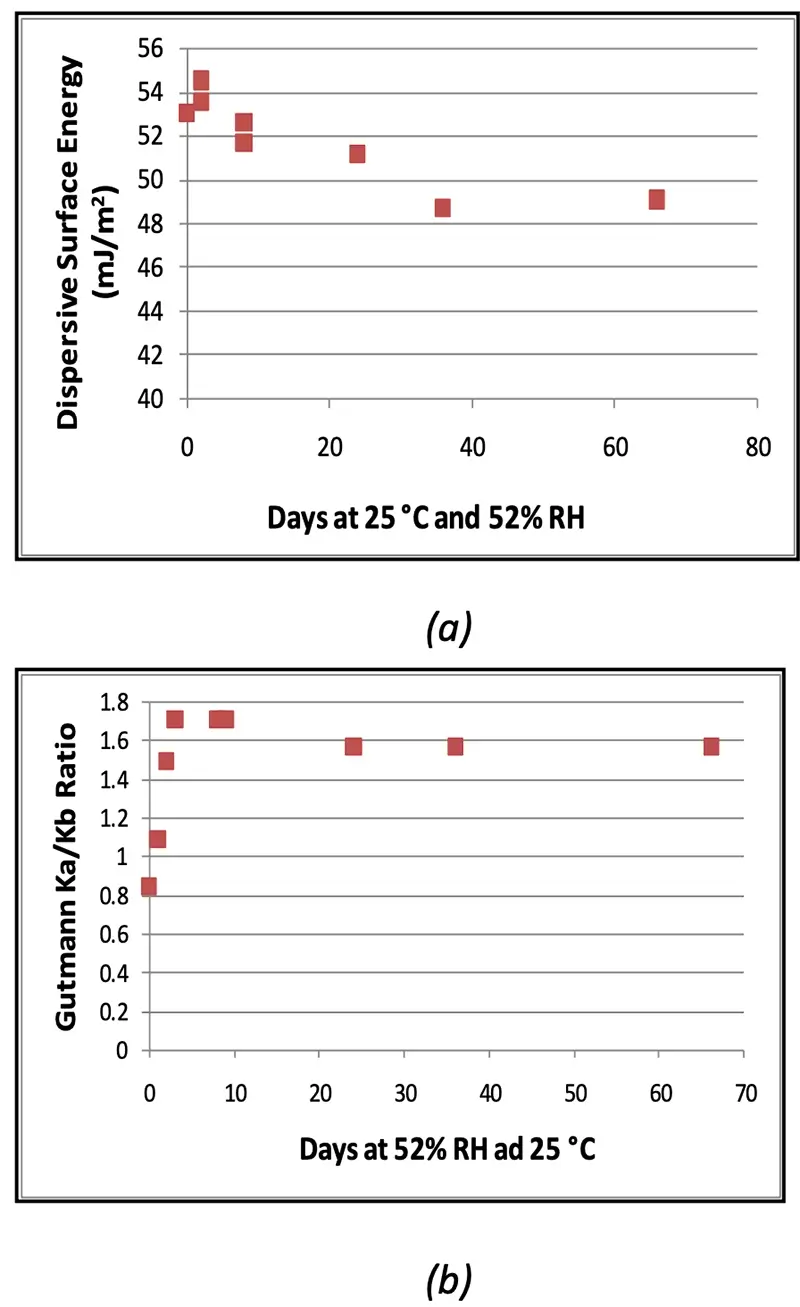
Figura 9.
(a) Energia superficial dispersiva e (b) razão Ka/Kb de Guttmann para uma amostra de budesonida moída medida em diferentes tempos de exposição a 52% de UR e 25 °C.
Heterogeneidade da Energia de Superfície
A natureza anisotrópica dos cristais, diferentes grupos funcionais, impurezas, sítios de defeito e os variados níveis de conteúdo amorfo fazem com que a maioria dos materiais seja energeticamente heterogênea. Por essas razões, pode ser benéfico medir uma distribuição ou intervalo de energias superficiais para um material específico.
Experimentos tradicionais de IGC SEA geralmente são realizados em diluição infinita, onde apenas as interações com os sítios mais energéticos são medidas. Para incluir sítios de menor energia, concentrações maiores de vapor (concentração finita) são injetadas.
No passado, pesquisadores usaram o IGC SEA para medir o potencial de adsorção ou distribuições de energia de adsorção para determinar a heterogeneidade energética de sólidos [23,54,55,56]. Contudo, esses valores dependem da molécula sonda utilizada e não são propriedades independentes do sólido.
Trabalhos recentes desenvolveram novos métodos para determinar distribuições de energia superficial em pós usando IGC SEA [57,58]. Pela primeira vez, esses métodos permitem a medição direta dos perfis de energia superficial dispersiva em função da cobertura superficial.
Medir perfis de heterogeneidade energética pode fornecer informações valiosas para a caracterização de superfícies complexas.
Para ilustrar, a Figura 10 mostra a energia superficial dispersiva em função da cobertura superficial (valor 0 corresponde à cobertura zero ou diluição infinita; valor 1, à cobertura completa) para três amostras diferentes de lactose [57].
Para o material moído, há um deslocamento na distribuição da energia superficial dispersiva para valores mais altos, em comparação com as outras duas amostras.
Combinando-se os resultados do DVS sobre o conteúdo amorfo (ver seção Quantificação do Conteúdo Amórfico acima), os dados de heterogeneidade do IGC SEA sugerem que a amostra moída possui uma quantidade significativa de material amorfo.
O conteúdo amorfo das amostras não tratada e recristalizada é extremamente pequeno. Embora as amostras não tratada e recristalizada apresentem energia superficial dispersiva similar em diluição infinita, as distribuições de energia para essas duas amostras são bastante diferentes.
A amostra recristalizada tem uma distribuição mais uniforme, sugerindo uma superfície energeticamente mais homogênea.
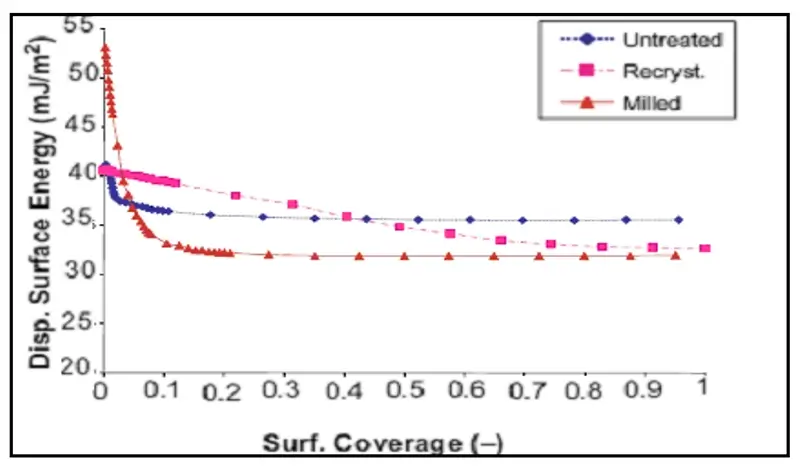
Figura 10: Perfil da energia superficial dispersiva para as amostras de lactose não tratada (azul), cristalina (rosa) e moída (vermelha).
Conclusão
Os materiais farmacêuticos apresentam uma ampla variedade de complexidade, variando desde materiais bem ordenados com uma rede cristalina definida até materiais completamente amorfos, sem ordem de longo alcance. O grau de desordem ou instabilidade termodinâmica desses materiais pode impactar todas as etapas do desenvolvimento farmacêutico, desde a formulação e o processamento até o armazenamento e a estabilidade do produto final.
Esses desafios tornam a caracterização dos materiais sólidos fundamental para o sucesso no desenvolvimento de produtos farmacêuticos e na implementação de estratégias de qualidade desde a concepção ( quality by design ). Técnicas de sorção de vapor, como DVS (Dynamic Vapor Sorption) e IGC SEA (Inverse Gas Chromatography Surface Energy Analysis), têm se mostrado ferramentas valiosas para a determinação de uma ampla gama de propriedades físico-químicas.
Neste estudo, diversos exemplos ilustraram como DVS e IGC SEA podem ser utilizados para caracterizar materiais cristalinos e desordenados, incluindo polimorfos, hidratos, sítios de defeito e materiais amorfos. As informações exclusivas obtidas por meio desses experimentos fornecem insights importantes para a caracterização e o desenvolvimento de materiais sólidos farmacêuticos.
Agradecimentos
Agradecemos especialmente ao Dr. Jerry Heng, do Imperial College London, Frank Thielmann, da Novartis, e Ron Gray, da Surface Measurement Systems, pelas valiosas discussões e contribuições.
Referências
[1] Hancock, B.C. e Zografi, G.,
Journal of Pharmaceutical Science
, 86 (1997) 1-12.
[2] Kontny, M.J. e Zografi, G., “Sorption of Water by Solids” em
Physical Characterization of Pharmaceutical Solids
, Brittain, H.G. (ed.), Marcel Dekker, New York, p. 387-418.
[3] Hancock, B.C. e Shamblin, S.,
Pharmaceutical Science and Technology Today
, 1 (1998) 345-351.
[4] Condor, J. e Young, C.,
Physicochemical Measurement by Gas Chromatography
, John Wiley and Sons, Chichester, UK (1979).
[5] Thielmann, F.,
Journal of Chromatography A
, 1037 (2004) 115-123.
[6] Buckton, G. e Gill, H.,
Advanced Drug Delivery Reviews
, 59 (2007) 1474-1479.
[7] Domingue, J., Burnett, D.J. e Thielmann, F.,
American Laboratory
, 7 (2003) 32.
[8] Brittain, H.G. (ed.),
Polymorphism in Pharmaceutical Solids
, John Wiley and Sons, New York (1998).
[9] Carstensen, J.T., em
Solid Pharmaceuticals: Mechanical Properties and Rate Phenomena
, Academic Press, New York (1980).
[10] Dong, Z. et al.,
Pharmaceutical Research
, 19 (2002) 330-336.
[11] Schmidt, A.C., Schwarz, I. e Mereiter, K.,
Journal of Pharmaceutical Sciences
, 95 (2006) 1097-1112.
[12] Carvajal, M.T. e Staniforth, J.N.,
International Journal of Pharmaceutics
, 307 (2006) 216-224.
[13] Guerrieri, P., Salameh, A.K. e Taylor, L.S.,
Pharmaceutical Research
, 24 (2006) 147-156.
[14] SMS Application Note 207.
[15] Tong, H.H.Y. et al.,
Pharmaceutical Research
, 19 (2002) 640-648.
[16] Tong, H.H.Y. et al.,
Pharmaceutical Research
, 18 (2001) 852-858.
[17] Tong, H.H.Y. et al.,
Journal of Pharmaceutical Sciences
, 94 (2005) 695-700.
[18] Henck, J.O., Griesser, U.J. e Burger, A.,
Pharm. Ind.
, 59 (1997) 165-169.
[19] Khawam, A. e Flanagan, D.J.,
J. Pharm. Sci.
, 95 (2006) 472-498.
[20] Beckmann, W. e Winter, G.,
Industrial Crystallization
(1999) 1-10.
[21] SMS Application Note 36.
[22] SMS Application Note 41.
[23] Burnett, D.J., Thielmann, F. e Sokoloski, T.,
Journal of Thermal Analysis
, 89 (2007) 693-698.
[24] Vogt, F.G. et al.,
Crystal Growth and Design
, 6 (2006) 2333-2354.
[25] Salameh, A.K. e Taylor, L.S.,
Journal of Pharmaceutical Sciences
, 95 (2006) 446-461.
[26] Manek, R.V. e Kolling, W.M.,
AAPS PharmSciTech
, 5 (2004) Article 14, 1-8.
[27] Surana, R., Pyne, A. e Suryanarayanan, R.,
AAPS PharmSciTech
, 4 (2003) Article 4, 1-10.
[28] SMS Application Note 507.
[29] Hogan, S.E. e Buckton, G.,
International Journal of Pharmaceutics
, 227 (2001) 57-69.
[30] Heng, J.Y.Y. et al.,
Langmuir
, 22 (2006) 2760-2769.
[31] Heng, J.Y.Y., Bismark, A. e Williams, D.R.,
AAPS PharmSciTech
, 7 (2006) Article 84, E1-E9.
[32] Heng, J.Y.Y., Thielmann, F. e Williams, D.R.,
Pharmaceutical Research
, 23 (2006) 1918-1927.
[33] Feng, T., Pinal, R. e Carvajal, M.T.,
Journal of Pharmaceutical Sciences
, 97 (2008) 3207-3221.
[34] Ohta, M. e Buckton, G.,
International Journal of Pharmaceutics
, 269 (2004) 81-88.
[35] Newell, H.E. et al.,
Pharmaceutical Research
, 18 (2001) 662-666.
[36] Feeley, J.C. et al.,
International Journal of Pharmaceutics
, 172 (1998) 89-96.
[37] Debnath, S. e Suryanarayanan, R.,
AAPS PharmSciTech
, 5 (2004) Article 8, 1-11.[38] Hancock, B.C. and Zografi, G.,
Journal of Pharmaceutical Science
, 86 (1997) 1-12.
[40] Buckton, G., and Darcy, P., Proc. 1st World Meeting APGI/APV, Budapest, 9/11 May 1995.
[41] Mackin, L., Zanon, R., Park, J.M., Foster, K., Opalenik, H., and Demonte, M., International Journal of Pharmaceutics , 231 (2002) 227.
[42] Young, P.M., Chiou, H., Tee, T., Traini, D., Chan, H.-K., Thielmann, F., and Burnett, D., Drug Development and Industrial Pharmacy , 33 (2007) 91-97.
[43] Sperling, L.H., Introduction to Physical Polymer Science . John Wiley & Sons, New York (1986).
[44] Roos, Y.H., Phase Transitions in Foods . Academic Press, New York (1995).
[45] Thielmann, F., Attwool, P., and Tojo, M., Nippon Yakugakkai Nenkai Koen Yoshishu , 123 (2003) 53.
[46] Buckton, G., Ambarkhane, A., and Pincott, K., Pharmaceutical Research , 21 (2004) 1554-1557.
[47] Ambarkhane, A.V., Pincott, K., and Buckton, G., International Journal of Pharmaceutics , 294 (2005) 129-135.
[48] Surana, R., Randall, L., Pyne, A., Vemuri, N.M., and Suryanarayanan, R., Pharmaceutical Research , 20 (2003) 1647-1654.
[49] Burnett, D.J., Thielmann, F., and Booth, J., International Journal of Pharmaceutics , 287 (2004) 123-133.
[50] Burnett, D.J., Thielmann, F., Sokoloski, T., and Brum, J., International Journal of Pharmaceutics , 313 (2006) 23-28.
[51] Khawam, A. and Flanagan, D.R., Journal of Pharmaceutical Sciences , 95 (2006) 472-498.
[52] Sheth, A.R., Zhou, D., Muller, F.X., and Grant, D.J.W., Journal of Pharmaceutical Sciences , 93 (2004) 3013-3026.
[53] Burnett, D.J., Thielmann, F., and Sokoloski., T.D., Journal of Thermal Analysis , 89 (2007) 693-698.
[54] Charmas, B. and Leboda, R., Journal of Chromatography A , 886 (2000) 133-152.
[55] Balard, H., Macromolecules , 11 (1978) 228.
[56] Thielmann, F. and Pearse, D., Journal of Chromatography A , 969 (2002) 323-327.
[57] Thielmann, F., Burnett, D.J., and Heng, J.Y.Y., Drug Development and Industrial Pharmacy , 33 (2007) 1240-1253.
[58] Ylä-Mäihänemi, P.P., Heng, J.Y.Y., Thielmann, F., and Williams, D.R., Langmuir (2008) in press.









