Na indústria farmacêutica e biotecnológica brasileira, a validação de processos Clean-in-Place (CIP) é crítica para garantir conformidade com ANVISA RDC 658/2022 , USP <643> e <645>, e FDA 21 CFR Part 211. Métodos tradicionais (manuais ou COP) aumentam risco de contaminação cruzada, tempo de inatividade e custos operacionais.

Sistemas CIP automatizados integrados a analisadores online de Total Organic Carbon (TOC), como o PAT700 da Beckman Coulter, permitem monitoramento em tempo real da Water for Injection (WFI) no enxágue final, reduzindo downtime significativamente, eliminando amostragens grab propensas a contaminação e acelerando liberação de equipamentos, com conformidade direta aos limites de TOC ≤ 500 ppb e condutividade ≤ 1,3 µS/cm a 25 °C (USP <643> e <645>).
Neste artigo, abordaremos:
- Vantagens do CIP sobre métodos tradicionais e COP
- Importância do monitoramento TOC no enxágue final
- Requisitos regulatórios: ANVISA RDC 658/2022, USP <643> e <645>, FDA 21 CFR Part 211
- Etapas de um ciclo CIP para biorreatores e fermentadores
- Limitações da análise laboratorial versus monitoramento online
- PAT700 Beckman Coulter: tecnologia e integração com PLC
O que é Clean-in-Place (CIP) e quais são suas vantagens?
CIP é o método automatizado de limpeza de equipamentos (vasos, tubulações, biorreatores) sem desmontagem significativa, circulando soluções alcalinas, ácidas e enxágues controlados. Diferencia-se do COP, que exige remoção de peças.

Vantagens principais: redução de 30–50% no tempo de ciclo produtivo, menor exposição a químicos perigosos, economia de mão de obra e maior reprodutibilidade, atendendo diretamente às exigências de validação da ANVISA e FDA para controle de contaminação cruzada.
O funcionamento baseia-se na circulação programada de diferentes soluções através do equipamento, incluindo pré-enxágue com água ambiente, lavagem alcalina com hidróxido de sódio ou potássio, lavagem ácida com ácido fosfórico, e enxágue final com Água para Injetáveis (WFI). Cada etapa possui parâmetros críticos de temperatura, concentração, tempo de contato e vazão que devem ser validados.
CIP versus COP: comparativo técnico para ambientes GMP

Embora CIP e COP compartilhem o objetivo de garantir limpeza validada dos equipamentos, suas abordagens diferem em automação, eficiência e aplicabilidade em ambientes regulados.
CIP
O sistema CIP oferece vantagens operacionais documentadas, menor exposição de operadores a agentes químicos, economia de mão de obra e maior reprodutibilidade dos resultados de limpeza — fator crítico para atender às exigências de validação da ANVISA e FDA quanto ao controle de contaminação cruzada.
COP
Por outro lado, o COP requer desmontagem de componentes, limpeza em tanques separados e remontagem, processo mais trabalhoso e com maior risco de contaminação durante o manuseio. Equipamentos com geometrias complexas ou pontos de difícil acesso podem demandar abordagem combinada.
Por que é importante monitorar a água do enxágue final em processos CIP?
O enxágue final com WFI remove resíduos de produto, detergentes e contaminantes. Sem monitoramento adequado, há risco de liberação prematura do equipamento, levando a OOS (out of specification), recalls ou não conformidades regulatórias.
USP <643> estabelece limite de TOC ≤ 500 µg/L e USP <645> condutividade ≤ 1,3 µS/cm (25 °C) para WFI. Monitoramento contínuo otimiza o ciclo, reduz consumo de água e assegura qualidade do próximo lote.
O monitoramento contínuo da qualidade da água de enxágue permite otimização do ciclo, redução do consumo de água e garantia de que o equipamento está pronto para o próximo lote de produção. Analisadores TOC quantificam resíduos orgânicos, enquanto a condutividade detecta resíduos inorgânicos provenientes de detergentes.
Requisitos regulatórios para validação de processos Clean-in-Place
A conformidade regulatória na validação de processos CIP envolve múltiplas normas nacionais e internacionais que estabelecem requisitos específicos para documentação, limites de aceitação e frequência de monitoramento.
ANVISA RDC 658/2022 e Boas Práticas de Fabricação
A ANVISA RDC 658/2022 estabelece as Diretrizes Gerais de Boas Práticas de Fabricação de Medicamentos no Brasil, alinhadas ao Esquema de Cooperação em Inspeção Farmacêutica (PIC/S). Esta resolução determina que a validação de limpeza deve demonstrar que o procedimento remove consistentemente resíduos de produto anterior, agentes de limpeza e contaminação microbiana.
O Sistema da Qualidade Farmacêutica exigido pela RDC 658/2022 deve incluir procedimentos documentados para qualificação IQ/OQ/PQ de sistemas CIP, estabelecimento de limites de aceitação baseados em avaliação de risco, e monitoramento contínuo para garantir manutenção do estado validado.
FDA 21 CFR Part 211 e controle de equipamentos
A regulamentação americana 21 CFR Part 211.67 exige procedimentos escritos para limpeza e manutenção de equipamentos, incluindo atribuição de responsabilidades, métodos de limpeza, cronogramas e registro de atividades. A seção especifica que equipamentos devem ser limpos, mantidos e sanitizados em intervalos apropriados para prevenir avarias ou contaminação que alterem a segurança, identidade, força, qualidade ou pureza do medicamento.
USP <643> e <645>: parâmetros para Water for Injection
Os capítulos USP <643> Total Organic Carbon e USP <645> Water Conductivity estabelecem os testes químicos primários para determinar o controle adequado de impurezas em sistemas de água farmacêutica.
Para WFI e Purified Water, o limite de TOC é ≤ 500 ppb (0,5 mg/L de carbono), avaliado por teste limite comparando a resposta da amostra com o padrão de sacarose USP a 500 ppb C.
A eficiência de oxidação do analisador deve estar entre 85-115% quando testado com 1,4-benzoquinona (composto de difícil oxidação) comparado à sacarose (composto de fácil oxidação). Este teste de adequação do sistema verifica que o equipamento consegue oxidar completamente diferentes tipos de matéria orgânica.
Etapas típicas de um ciclo CIP para biorreatores e fermentadores
Um ciclo CIP completo para equipamentos de bioprocessamento segue sequência padronizada para remoção eficaz de contaminantes orgânicos, inorgânicos e microbiológicos.
Estrutura típica do ciclo:
- Pré-enxágue: 2 ciclos com água em temperatura ambiente para remoção de resíduos grosseiros do produto; drenados diretamente.
- Lavagem alcalina: Solução de NaOH ou KOH aquecida (geralmente 50–80 °C), circulada para remoção de proteínas, gorduras e resíduos orgânicos.
- Enxágue pós-alcalino: Água purificada em passagem única para remoção da solução alcalina e resíduos solúveis.
- Lavagem ácida: Solução de H₃PO₄ aquecida (geralmente 50–70 °C) para neutralização de resíduos alcalinos e remoção de incrustações minerais/oxidação em aço inoxidável.
- Enxágue pós-ácido: Água purificada quente em passagem única.
- Enxágue final: WFI monitorada online por TOC (≤ 500 ppb) e condutividade (≤ 1,3 µS/cm a 25 °C) até atingir especificação; frequentemente seguido de blow-down com ar estéril para drenagem completa.
Parâmetros críticos (temperatura, concentração, tempo de contato, vazão e pressão) devem ser monitorados e mantidos dentro das faixas validadas pelo sistema de controle (PLC/SCADA).
Como funciona um analisador TOC (princípio básico)?
Analisadores TOC oxidam matéria orgânica por radiação UV intensa, convertendo-a em CO₂. Primeiro mede-se o TIC (CO₂ dissolvido); após oxidação, mede-se o CO₂ total. A diferença corresponde ao TOC (por condutividade ou detecção direta de CO₂).
- Eficiência de oxidação: 85–115% (conforme USP <643>)
- Limite de detecção típico: 0,05–0,1 mg/L
- Aplicação ideal: monitoramento de águas farmacêuticas de alta pureza (WFI/PW)
A Figura 2 ilustra o princípio da condutometria direta: captura da amostra, oxidação UV com lâmpada ativada, aumento de condutividade proporcional ao TOC e detecção de endpoint dinâmico.
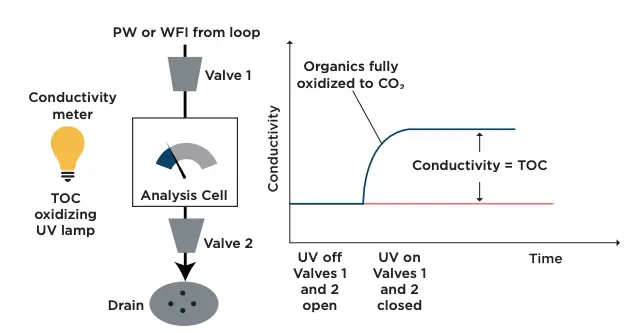
Como e onde o TOC é medido no processo CIP?
Quais as desvantagens da análise TOC por amostras grab (laboratório ou at-line)?
Quais as vantagens de usar analisadores TOC online em CIP?
PAT700 Beckman Coulter: analisador TOC para processos Clean-in-Place
O PAT700 TOC Analyzer da Beckman Coulter Life Sciences utiliza condutometria direta (DC) com uma única célula de condutividade para medir o aumento de condutividade causado pelo CO₂ gerado na oxidação UV da matéria orgânica. Conta com lâmpadas UV duplas (principal e standby) para maior uptime.

Conheça o PAT700 - Analisador de TOC
Medição 3 em 1 TOC condutividade temperatura, Conformidade farmacopeica USP 643 645 validada,
Ciclo de análise:
- Amostra de WFI do dreno é capturada na célula por válvulas automatizadas.
- Lâmpada UV é ativada para oxidar orgânicos em CO₂.
- Detecção de endpoint dinâmico garante oxidação completa.
- Diferença de condutividade é proporcional ao TOC.
Reporta TOC e condutividade simultaneamente, opera sem reagentes consumíveis, mantém calibração estável por até 12 meses e requer apenas uma manutenção preventiva anual .
Vantagens do PAT700 para aplicações CIP
Características que o tornam ideal para CIP:
- Ausência de membranas: elimina fouling por resíduos de limpeza e ressecamento em paradas prolongadas.
- Célula única de condutividade: menor incerteza combinada vs. sistemas com múltiplas células.
- Adequado para amostras intermitentes: projetado para pequenas alíquotas típicas de CIP, sem necessidade de fluxo contínuo para estabilização.
-
- Manutenção anual: custo de propriedade significativamente menor que tecnologias baseadas em membranas.
Analisadores com membranas (condutividade indireta) sofrem ressecamento e fouling em skids CIP de uso frequente ou inativos, exigindo substituições e recalibrações frequentes. Sistemas com múltiplas células apresentam maior incerteza e rotinas de recalibração antes de cada uso.
Análise TOC laboratorial versus monitoramento online em processos CIP
Limitações da análise por amostras grab
- Risco elevado de contaminação (lixiviação iônica, dissolução de CO₂ atmosférico).
- Superestimação de TOC por artefatos de coleta.
- Necessidade de múltiplas amostras → custo de reagentes e mão de obra.
- Atraso na liberação do equipamento (horas vs. minutos).
- Redução de throughput e economia de escala.
Benefícios do monitoramento TOC online
- Dados em tempo real → liberação imediata do equipamento.
- Eliminação de contaminação por manuseio manual.
- Detecção simultânea de TOC e condutividade (resíduos orgânicos e inorgânicos).
- Aumento de uptime típico de até 40% em processos intensivos.
- Integração com PLC para automação da decisão de liberação.
Transição para online reduz falsos positivos e melhora eficiência operacional.
Integração do PAT700 com sistemas PLC em skids CIP
A Figura 1 mostra o esquema típico de um skid CIP equipado com o PAT700 TOC Analyzer para monitoramento online da WFI durante o enxágue final.
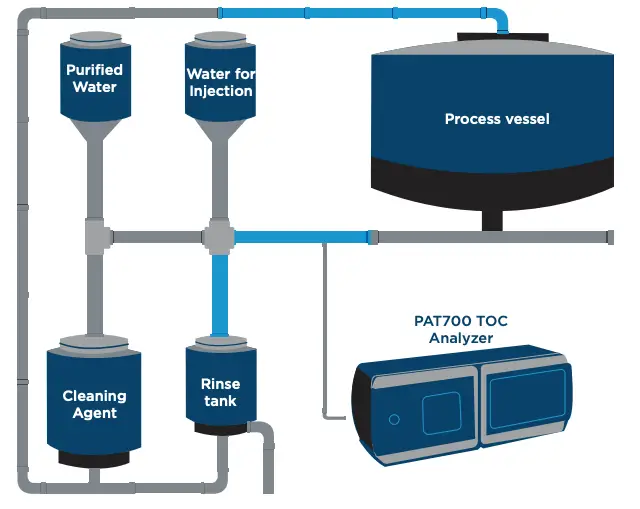
Integração via sinais digitais com PLC/SCADA, incluindo controle/aborto de amostra. Fluxo típico:
- Step 1: PLC envia “start analysis” ~5 minutos antes do fim do enxágue final.
- Step 2: PAT700 enxágua linha por 2 minutos, captura alíquota fixa e analisa TOC + condutividade.
- Step 3: Resultados reportados ao PLC para decisão automática (prosseguir, abortar ou liberar).
Permite registro eletrônico completo, atendendo ANVISA e FDA 21 CFR Part 11 (integridade de dados).
Validação e qualificação de sistemas CIP: IQ, OQ e PQ
Segue ICH Q7 e ANVISA IN 138/2022 (baseado em risco justificado).
- IQ (Qualificação de Instalação) :
- Verifica configuração conforme construída, desenhos, certificados de materiais, instalação correta e calibração documentada de instrumentos.
- OQ (Qualificação Operacional) :
- Desafia receitas, alarmes, intertravamentos e desempenho em condições normais e limites de faixa, verificando utilidades e sensores.
- PQ (Qualificação de Performance) :
- Executa corridas baseadas em risco (produtos, sujidades, piores casos), demonstrando conformidade com critérios de aceitação em rotina.
Revalidação periódica conforme Gerenciamento de Riscos de Qualidade, acionada por mudanças significativas em processo, equipamento ou requisitos regulatórios.
FAQ: Perguntas frequentes sobre Clean-in-Place e analisadores TOC
1. Qual a diferença entre CIP e COP na indústria farmacêutica?
CIP (Clean-in-Place) é a limpeza automatizada sem desmontagem do equipamento, enquanto COP (Clean-Out-of-Place) requer remoção de componentes para limpeza em tanques separados. CIP oferece maior eficiência, reprodutibilidade e menor risco de contaminação durante manuseio.
2. Qual o limite de TOC para Water for Injection segundo USP <643>?
O limite é de 500 µg/L (500 ppb ou 0,5 mg/L) de carbono. O teste utiliza solução de sacarose como padrão de referência, e a resposta do analisador a esta concentração define o limite real para cada sistema.
3. Por que o enxágue final com WFI é monitorado por TOC e condutividade?
TOC detecta resíduos orgânicos provenientes do produto e alguns detergentes, enquanto condutividade identifica resíduos inorgânicos de agentes de limpeza. A combinação garante detecção completa de contaminantes.
4. Qual a frequência recomendada para teste de adequação do sistema (SST) em analisadores TOC?
USP <643> não especifica frequência fixa, pois depende da estabilidade do instrumento e fatores de risco do sistema de água. Laboratórios devem definir frequência baseada em histórico de desempenho e criticidade da aplicação.
5. Quais são as etapas de um ciclo CIP típico para biorreatores?
Pré-enxágue com água ambiente, lavagem alcalina com NaOH ou KOH aquecido, enxágue intermediário, lavagem ácida com H₃PO₄, enxágue pós-ácido, e enxágue final com WFI monitorada até atingir especificação.
6. Quais normas regulatórias se aplicam à validação de CIP no Brasil?
ANVISA RDC 658/2022 e instruções normativas complementares, especialmente IN 138/2022 sobre qualificação e validação. Internacionalmente, FDA 21 CFR Part 211, USP <643> e <645>, ICH Q7 e EU GMP Annex 15 são referências aplicáveis.
7. Quais as vantagens do monitoramento TOC online versus análise laboratorial?
Eliminação de contaminação por amostragem, dados em tempo real para liberação imediata, redução de custos com reagentes e mão de obra, aumento significativo de uptime produtivo e integração direta com sistemas de controle automatizado.









