Análise de Colocalização-NTA em Preparações Multimarcadas de Vesículas Extracelulares Derivadas de Plaquetas
Instituições envolvidas
:
Particle Metrix GmbH
, Inning, Alemanha
Instituto de Medicina Transfusional (AG Giebel),
Hospital Universitário de Essen
,
Universidade de Duisburg-Essen
, Alemanha
Introdução à Colocalização por NTA (C-NTA)
A Análise de Rastreio de Nanopartículas com Colocalização (C-NTA) representa um avanço importante nas metodologias baseadas em NTA fluorescente (F-NTA) . Além de medir o tamanho e a concentração de partículas marcadas com fluorescência, a C-NTA permite detectar rapidamente dois ou mais alvos fluorescentes presentes simultaneamente em uma única vesícula extracelular (EV).
Esse tipo de análise é possível graças ao uso de múltiplos lasers e à seleção de filtros de fluorescência correspondentes , o que viabiliza a quantificação de subpopulações fluorescentes individuais , bem como de partículas com dupla marcação positiva para diferentes marcadores de superfície.
Estudo Anterior e Continuidade
Após o sucesso na demonstração da C-NTA com vesículas extracelulares mesenquimais (MSC-EVs) duplamente marcadas em nosso estudo anterior, e a validação dos resultados por meio de citometria de fluxo por imagem , esta nota descreve uma aplicação mais avançada:
A análise de MSC-EVs multimarcadas , utilizando o sistema PX-430 QUATT NTA com quatro lasers .
Palavras-chave
Colocalização , multimarcação, Análise de Rastreio de Nanopartículas (NTA), vesículas extracelulares , CD41, CD9, CellMask Deep Red, anticorpo, fluorescência , membrana, N-40
Introdução
As vesículas extracelulares (EVs) de tipos celulares selecionados estão sendo estudadas intensamente devido ao seu grande potencial terapêutico . Essas vesículas podem ser classificadas de acordo com sua origem, porém, estudos recentes mostram um alto grau de heterogeneidade mesmo dentro de classes específicas de EVs[1-6].
Um dos principais objetivos da pesquisa com EVs é estabelecer e padronizar métodos robustos para detectar essa heterogeneidade em amostras purificadas, especialmente nas frações com vesículas menores que 200 nm [1,3]. No entanto, o avanço nessa área ainda é dificultado pelo fato de que os métodos disponíveis para analisar EVs de menor tamanho são, em sua maioria, muito demorados ou capazes de quantificar apenas um número limitado de parâmetros [7,8].
A Evolução da F-NTA para a C-NTA
A C-NTA , derivada das técnicas de F-NTA (Análise Fluorescente de Nanopartículas) , permite detectar biomarcadores específicos ao captar múltiplos sinais fluorescentes de diferentes fenótipos de EVs em uma única amostra . Além disso, a técnica revela a colocalização de biomarcadores em vesículas individuais , tudo isso em uma medição rápida e eficiente .
Continuidade do Estudo Anterior
Esta nota é uma continuação do nosso estudo anterior, no qual realizamos experimentos de C-NTA em EVs derivadas de células-tronco mesenquimais (MSC-EVs), obtidas de lisado de plaquetas humanas e marcadas com dois corantes fluorescentes.
Neste novo trabalho, as MSC-EVs foram multimarcadas com:
-
CellMask™ Deep Red (CMDR) para marcação de membrana;
-
Anticorpo anti-CD9 conjugado ao corante Pacific Blue ;
-
Anticorpo anti-CD41 conjugado ao Alexa Fluor™ 488 .
Detectamos e quantificamos uma fração significativa de EVs duplamente positivas em cada combinação de canais de C-NTA. Também demonstramos que a ordem de aplicação dos anticorpos e corantes não influencia nas taxas de colocalização obtidas.
Metodologia
Cultura Celular e Purificação de MSC-EVs
As vesículas extracelulares (EVs) foram obtidas a partir do meio condicionado de culturas de MSCs (células-tronco mesenquimais). A seguir, o material foi submetido a etapas específicas de purificação para isolamento das EVs, conforme protocolo detalhado no segmento seguinte do estudo.
Procedimento de Marcação Fluorescente e Preparação da Amostra
Precipitação por PEG
As EVs foram isoladas a partir de meio condicionado com lisado de plaquetas humanas , utilizando um procedimento de precipitação com PEG , conforme descrito no estudo anterior [^15,^16].
Marcação Fluorescente
Para a marcação com anticorpos, foi preparado um cocktail fluorescente com os seguintes componentes:
-
1 μL de MSC-EVs (concentração: 4,2 × 10¹¹ EV/mL)
-
5 μL de anticorpo anti-CD9 humano (clone MEM-61), conjugado com Pacific Blue (diluição 1:25)
-
5 μL de anticorpo anti-CD41 humano (clone MEM-06), conjugado com Alexa Fluor™ 488 (diluição 1:125)
-
1 μL do corante de membrana CellMask™ Deep Red (CMDR) , diluído 1:250
Os anticorpos foram fornecidos pela EXBIO (República Tcheca) , enquanto o corante CMDR foi obtido da Thermo Fisher Scientific (Alemanha) .
A mistura de EVs e anticorpos foi incubada por 1 hora no escuro à temperatura ambiente . Em seguida, adicionou-se o corante CMDR, com mais 1 hora de incubação , totalizando 2 horas de incubação . Após esse período, o coquetel foi diluído com tampão PBS livre de partículas até atingir um volume final de 1 mL para as análises subsequentes por NTA.
Controle com Detergente
Para verificar a especificidade da marcação , foi preparado um controle utilizando o detergente não iônico NP-40 Alternative (Calbiochem, Merck – Alemanha), capaz de romper as membranas das EVs.
Após a incubação da amostra marcada:
-
Foram adicionados 12 μL de solução 0,5% de NP-40 (diluída em PBS livre de partículas),
-
Alcançando uma concentração final de 0,25% de NP-40 ,
-
Seguido de mais 30 minutos de incubação no escuro à temperatura ambiente .
A mistura lisada foi diluída em 1 mL de PBS para análise por NTA.
Análise por NTA e Medições de Colocalização
As medições de tamanho , concentração e colocalização das EVs foram realizadas com o sistema ZetaView® PMX-430 QUATT , equipado com o software Particle Metrix Suite e o ZetaNavigator v1.1 .
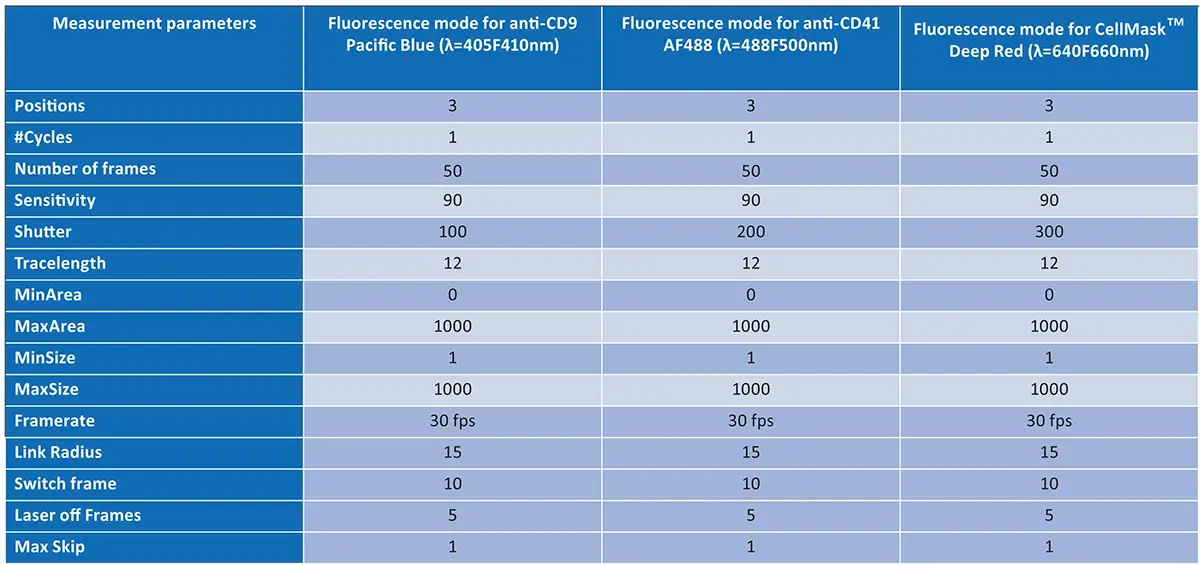
As condições e parâmetros de medição estão descritos na Tabela 1 (abaixo) e seguem os mesmos procedimentos detalhados no estudo anterior .
A principal diferença nesta nova análise foi o uso de três pares de canais de fluorescência (fontes de 405 nm, 488 nm e 640 nm), em vez de apenas um par (488 nm e 640 nm), ampliando a precisão na determinação dos índices de colocalização .
Tabela 1. Parâmetros de medição utilizados para colocalização no modelo ZetaView® PMX-430 QUATT
Resultados e Conclusões
Medições de Tamanho e Concentração
As análises padrão de NTA, realizadas no modo de espalhamento (scatter) com o sistema ZetaView® , indicaram um diâmetro mediano ( X50 ) de 117 nm e uma concentração de 2,5 × 10¹¹ partículas/mL .
Para caracterizar fenotipicamente as EVs presentes na amostra, as partículas foram multi-marcadas com os anticorpos anti-CD9 (Pacific Blue), anti-CD41 (AF488) e com o corante de membrana CellMask™ Deep Red (CMDR) .
A escolha cuidadosa dos fluorocromos visou evitar sobreposição (spill-over) entre os canais de fluorescência individuais durante as medições.
Análise de Colocalização com Múltiplos Marcadores
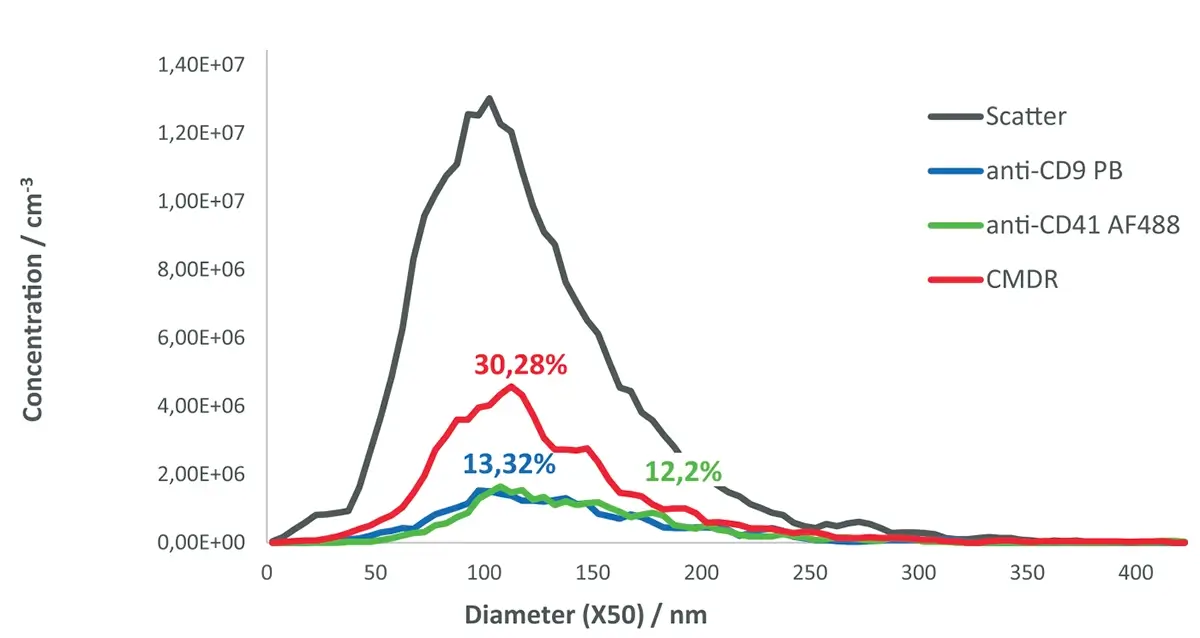
A Figura 1 mostra os histogramas de tamanho de partículas das MSC-EVs obtidos tanto no modo de espalhamento (cinza) quanto nas detecções em fluorescência :
-
Linha azul : detecção com anti-CD9 (Pacific Blue)
-
Linha verde : detecção com anti-CD41 (AF488)
-
Linha vermelha : detecção com CMDR (CellMask™ Deep Red)
Detecções Positivas Duplas
As medições por C-NTA realizadas com os três marcadores resultaram em detecções duplas positivas em todas as combinações de canais de fluorescência utilizando o sistema ZetaView®.
Resultados Detalhados:
-
EVs positivas para CD9
-
Diâmetro mediano (X50): 128,8 nm
-
Concentração: 3,3 × 10¹⁰ partículas/mL
-
-
EVs positivas para CD41
-
Diâmetro médio: 136,6 nm
-
Concentração: 3,05 × 10¹⁰ partículas/mL
-
Observação: ligeiramente maiores do que as partículas detectadas nos outros modos
-
-
EVs positivas para CMDR (membrana)
-
Diâmetro mediano: 124,8 nm
-
Concentração: 7,57 × 10¹⁰ partículas/mL
-
Esses resultados confirmam que a C-NTA permite a detecção eficiente de múltiplos marcadores em uma única vesícula extracelular (EV) , com alta resolução e sem interferência entre os canais de fluorescência.
Concentração e Interpretação dos Resultados
A concentração observada de partículas positivas para CMDR foi mais que o dobro da encontrada nas populações CD9+ e CD41+ , sugerindo a presença de:
-
Outras vesículas extracelulares não marcadas por CD9/CD41, e/ou
-
Partículas contendo membranas lipídicas , mas que não expressam tetraspaninas .
Percentuais de Partículas Positivas por Canal de Fluorescência
A distribuição das partículas positivas detectadas por fluorescência nos diferentes canais foi a seguinte:
-
CD9 (Pacific Blue – canal azul) : 13,3%
-
CD41 (AF488 – canal verde) : 12,2%
-
CMDR (CellMask™ Deep Red – canal vermelho) : 30,28%
Vale destacar que a amostra analisada não foi purificada , o que significa que, além das EVs, há a possibilidade de conter outras nanopartículas, como fragmentos de membranas, lipoproteínas ou microvesículas.
Isso explica os resultados elevados com CMDR , já que esse corante marca estruturas de membrana em geral e não é específico para EVs . Assim, qualquer partícula que contenha lipídios de membrana pode ser detectada no canal de 640 nm (CMDR).
Avaliação com Detergente NP-40
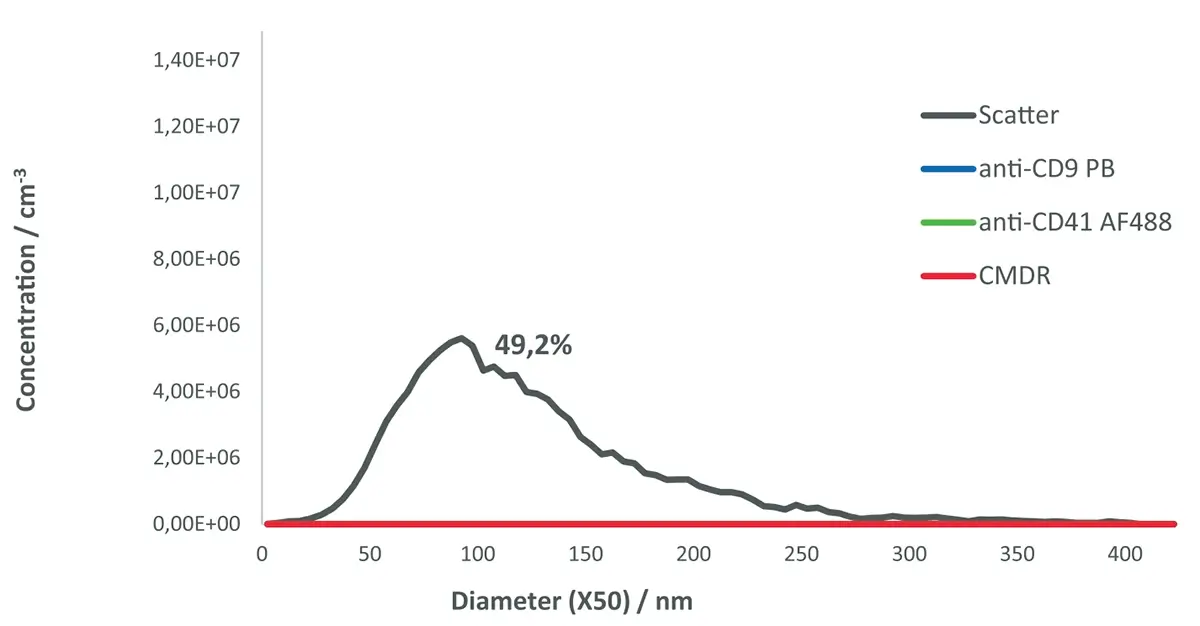
A Figura 2 apresenta a distribuição de tamanho das EVs multimarcadas após tratamento com 0,5% de NP-40 , um detergente utilizado para romper partículas com membranas.
Após a incubação com o NP-40:
-
Houve uma redução de 50,8% no número de partículas detectadas no modo scatter
-
E nenhuma partícula foi detectada no modo fluorescente
Interpretação dos Resultados com NP-40
Esses dados indicam que aproximadamente metade das partículas presentes na amostra possuem membranas lipídicas sensíveis ao detergente , ou seja, são de fato vesículas extracelulares ou outras estruturas membranosas.
A outra metade — que permaneceu visível no modo de espalhamento — provavelmente representa partículas não membranosas , como agregados proteicos, resíduos ou nanopartículas não biológicas resistentes ao NP-40 .
Estudos de Colocalização com C-NTA
A técnica de Colocalization-NTA (C-NTA) permite que o mesmo volume de partículas marcadas com fluorescência seja iluminado de forma extremamente rápida, utilizando três lasers com diferentes comprimentos de onda em sequência. Os sinais de fluorescência são então detectados em série com os filtros correspondentes (conforme mostrado na Tabela 1).
Detecção de colocalização entre marcadores
A análise de EVs multi-marcadas com C-NTA revelou taxas de colocalização entre 39% e 41% , conforme apresentado nas Figuras 3A-C. O par de marcadores CD9-CD41 mostrou a maior especificidade na detecção dos vesículas, uma vez que ambos os anticorpos estavam conjugados com fluoróforos e são direcionados especificamente às tetraspaninas presentes na superfície das EVs.
Além disso, os pares CD9-CMDR e CD41-CMDR apresentaram taxas de colocalização comparáveis, com 41% (±2) e 38% (±4,5) , respectivamente. É importante destacar que o corante CellMask™ Deep Red (CMDR) possui uma ligação menos seletiva, pois se associa de maneira ubíqua a todas as estruturas que contenham membranas lipídicas, e não apenas às vesículas extracelulares.
Comparação com estudo anterior
Quando comparado ao estudo anterior realizado pelo mesmo grupo ( veja aqui ), observou-se uma redução na taxa de colocalização entre CD9 e CD41 , de 58,5% para 39% . Esta diferença provavelmente se deve ao uso de um lote diferente de MSC-EVs , o que ressalta a importância de padronizar as amostras nos estudos de colocalização.
Controle com detergente NP-40
Como esperado, nenhuma colocalização foi observada nas amostras-controle tratadas com 0,5% de NP-40 , um detergente que rompe a membrana das EVs. Nas Figuras 3D-F, é possível visualizar que, após a lise das vesículas, os sinais fluorescentes desaparecem, reforçando que os eventos detectados anteriormente são, de fato, dependentes da integridade das membranas.
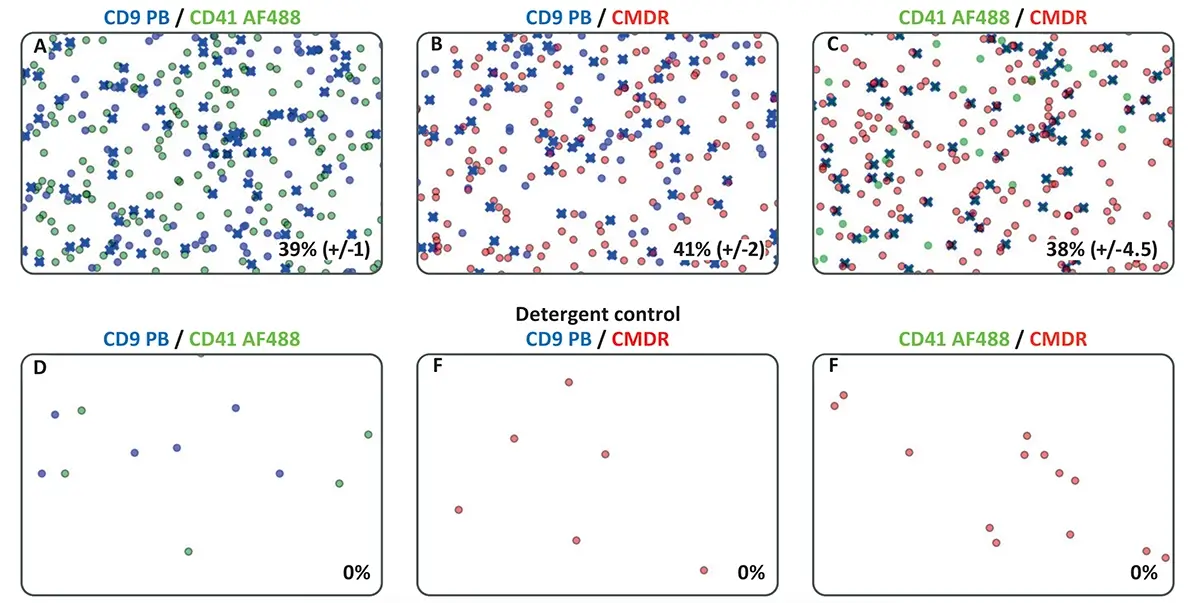
A Figura 3 apresenta seções representativas das coordenadas x-y dos centróides dos eventos de espalhamento de MSC-EVs que foram multi-marcadas com os anticorpos CD9 Pacific Blue, CD41 AF488 e com o corante de membrana CMDR . Cada ponto azul, verde e vermelho representa uma vesícula positiva para CD9 , CD41 e CMDR , respectivamente.
Os eventos duplamente positivos são destacados com uma cruz azul e os respectivos percentuais de colocalização são apresentados no canto inferior direito de cada gráfico.
-
A-C: mostram os eventos de colocalização entre os pares de canais de fluorescência.
-
D-F: representam os controles com detergente (tratados com NP-40 0,5%), nos quais nenhum evento de colocalização foi detectado , confirmando a eficácia da lise das vesículas membranosas.
Essa visualização reforça a especificidade dos marcadores utilizados, permitindo distinguir entre diferentes subpopulações de EVs e estruturas semelhantes.
Diferentes Sequências de Marcação de EVs
Ao utilizar múltiplos corantes ou anticorpos para C-NTA , existe a possibilidade de variações nos resultados dependendo da sequência de adição dos reagentes. Para investigar se a ordem de marcação interfere nas taxas de colocalização, foram testadas quatro sequências diferentes de coloração nas MSC-EVs.
Resultado do teste de sequência de marcação
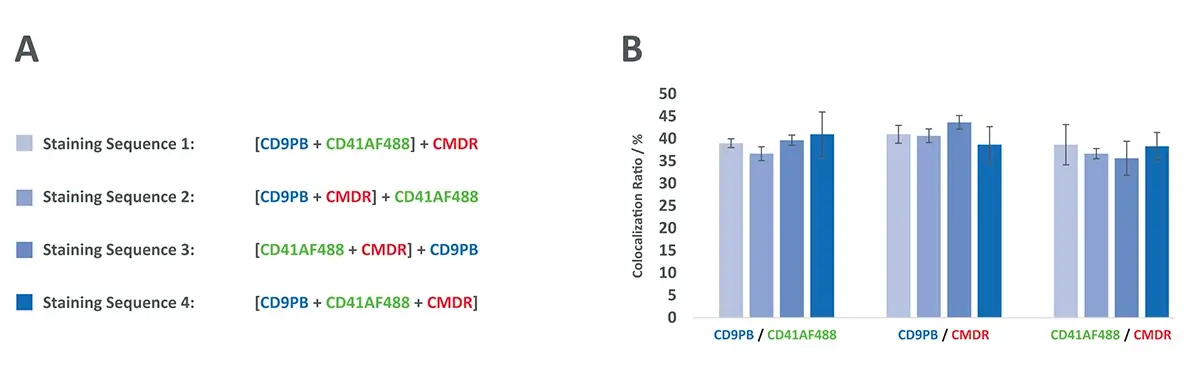
Conforme ilustrado na Figura 4 , os resultados demonstraram que, pelo menos com essa combinação específica de marcadores (CD9, CD41 e CMDR) , não houve diferença significativa nas taxas de colocalização entre as diferentes ordens de adição dos corantes e anticorpos.
Esse achado é relevante, pois indica uma robustez no protocolo de marcação , conferindo maior flexibilidade para estudos futuros com múltiplas cores e evitando viés experimental relacionado à ordem dos reagentes.
Controles FMO (Fluorescence Minus One)
Os controles FMO (Fluorescence Minus One) são fundamentais para a identificação precisa de populações positivas e negativas durante experimentos com fluorescência. Esses controles ajudam a eliminar dúvidas sobre sinais falsos positivos , especialmente em experimentos com múltiplos fluoróforos.
Durante a aquisição dos dados, pode haver dispersão de fluorescência (spill-over), principalmente quando fluoróforos muito brilhantes estão envolvidos. Essa sobreposição pode afetar a leitura, mesmo quando não é necessária compensação direta, como neste estudo, e também pode ocorrer por excitação cruzada entre lasers .
Implementação dos controles FMO
No início do novo experimento multicolor, foram realizados controles FMO para todos os fluoróforos do painel . Durante o processo de coloração, um dos corantes ou anticorpos foi intencionalmente omitido , enquanto a análise de colocalização foi mantida ativa em todos os canais de fluorescência disponíveis (ver Figura 5 ).
O objetivo foi garantir que os sinais observados fossem realmente devidos à presença dos marcadores e não resultado de interferências ópticas. Como esperado, dependendo da combinação de fluoróforos utilizados, apenas um par de canais de fluorescência apresentou eventos de colocalização quando faltava um dos marcadores. Isso reforça a especificidade dos eventos positivos identificados no estudo completo.
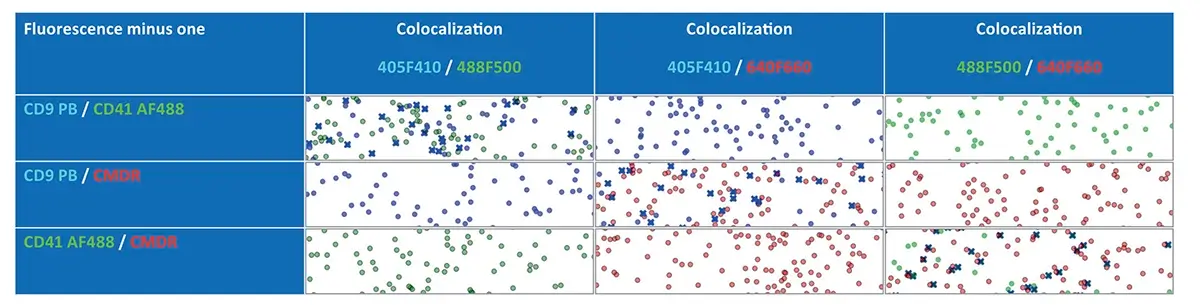
Figura 5: ilustra os resultados obtidos com os controles FMO (Fluorescence Minus One) aplicados às vesículas extracelulares derivadas de células-tronco mesenquimais (MSC-EVs).
Na coluna à esquerda , são exibidos os resultados das amostras com dupla marcação , nas quais o terceiro marcador (anticorpo ou corante de membrana CMDR) foi propositalmente omitido. As colunas 2 a 4 mostram os pares de canais de fluorescência utilizados para detectar as EVs rotuladas.
Os controles FMO demonstraram que, na ausência de um dos fluoróforos, a colocalização foi observada apenas em um par de canais fluorescentes , validando a especificidade das marcações e a ausência de interferência cruzada relevante entre os fluoróforos utilizados.
Resumo
Caracterização e Fenotipagem de EVs com C-NTA
Neste estudo, descrevemos pela primeira vez a caracterização e o fenótipo de vesículas extracelulares (EVs) multimarcadas utilizando a técnica de C-NTA (Análise de Rastreamento de Nanopartículas com Colocalização) . Foi possível detectar, de forma rápida e reprodutível, as proporções de EVs duplamente positivas para CD9/CD41 , CD9/CMDR e CD41/CMDR , utilizando múltiplos lasers e pares de filtros de fluorescência selecionáveis.
Informações Simultâneas de Tamanho, Concentração e Colocalização
Durante cada medição com C-NTA, o movimento browniano é monitorado, permitindo a obtenção simultânea de distribuições de tamanho e concentrações precisas das subpopulações fluorescentes de EVs, juntamente com os dados de colocalização.
Controle de Artefatos e Especificidade dos Sinais
A presença de falsos positivos e artefatos foi descartada com o uso de controles com detergente , que confirmaram que as partículas colocalizadas eram EVs. Os controles FMO (Fluorescence Minus One) não evidenciaram espalhamento de fluorescência entre os canais, comprovando a especificidade das marcações e dos fluoróforos utilizados.
Influência da Ordem de Marcação
Com a adição de cada novo marcador, aumentam exponencialmente as possibilidades de sequência de marcação. Foram testadas diferentes combinações de ordem de coloração, e os resultados indicaram que a sequência de marcação não afeta significativamente as taxas de colocalização .
Validação com Controles Negativos
Como nos estudos anteriores, controles negativos preparados sem EVs de MSC, mas com todos os outros reagentes, apresentaram um número significativamente menor de partículas quando comparados às amostras positivas. No entanto, o diâmetro médio das partículas se manteve semelhante (dados não apresentados).
Conclusões e Aplicações do C-NTA
A técnica C-NTA altamente direcionada provou ser eficaz para a quantificação de EVs de interesse , utilizando anticorpos conjugados e corantes de membrana. O C-NTA se destacou como uma ferramenta precisa para detecção e identificação de biomarcadores em nível de partícula única , fornecendo simultaneamente informações de tamanho, concentração e colocalização em uma única medição.
Dessa forma, o C-NTA representa uma abordagem poderosa, sensível e precisa para ajudar a desvendar os muitos mistérios que ainda cercam o universo das vesículas extracelulares.
Referências Científicas sobre Vesículas Extracelulares e Análise por C-NTA
-
1. Koliha N, Heider U, Ozimkowski T, et al.
Melanoma affects the composition of blood cell-derived extracellular vesicles . Frontiers in Immunology . 2016 Jul;7:282.
🔗 https://doi.org/10.3389/fimmu.2016.00282
Este estudo mostra como o melanoma pode impactar a composição das vesículas extracelulares derivadas de células do sangue, sendo relevante para análises com C-NTA (Nanoparticle Tracking Analysis). -
2. Koliha N, Wiencek Y, Heider U, et al.
A novel multiplex bead-based platform highlights the diversity of extracellular vesicles . Journal of Extracellular Vesicles . 2016;5:29975.
🔗 https://doi.org/10.3402/jev.v5.29975
Apresenta uma plataforma de citometria de fluxo multiplex inovadora que permite distinguir subpopulações de vesículas extracelulares. -
3. Wiklander OP, Nordin JZ, O'Loughlin A, et al.
Extracellular vesicle in vivo bio-distribution is determined by cell source, route of administration and targeting . Journal of Extracellular Vesicles . 2015;4:26316.
🔗 https://doi.org/10.3402/jev.v4.26316
Explora a biodistribuição das EVs no organismo, com ênfase na origem celular e vias de administração – dados importantes para aplicações terapêuticas. -
4. Wiklander OPB, Bostancioglu RB, Welsh JA, et al.
Systematic methodological evaluation of a multiplex bead-based flow cytometry assay for detection of extracellular vesicle surface signatures . Frontiers in Immunology . 2018 Jun;9:1326.
🔗 https://doi.org/10.3389/fimmu.2018.01326
Avaliação metodológica de ensaios multiplex para análise de marcadores de superfície em EVs, contribuindo para a padronização da caracterização. -
5. Kowal J, Arras G, Colombo M, et al.
Proteomic comparison defines novel markers to characterize heterogeneous populations of extracellular vesicle sub-types . PNAS . 2016 Feb 8.
🔗 https://doi.org/10.1073/pnas.1521230113
Estudo proteômico que define marcadores específicos para diferentes subtipos de vesículas extracelulares. -
6. Giebel B.
On the function and heterogeneity of extracellular vesicles . Annals of Translational Medicine . 2017 Mar;5(6):150.
🔗 https://doi.org/10.21037/atm.2017.03.41
Revisão sobre a heterogeneidade e as múltiplas funções das EVs, essencial para quem estuda biomarcadores e comunicação intercelular. -
7. Witwer KW, Buzas EI, Bemis LT, et al.
Standardization of sample collection, isolation and analysis methods in extracellular vesicle research . Journal of Extracellular Vesicles . 2013;2:20360.
🔗 https://doi.org/10.3402/jev.v2i0.20360
Recomendação amplamente citada para padronização de métodos de coleta, isolamento e análise de EVs, sendo referência para estudos com C-NTA e citometria. -
8. Sharma S, Rasool HI, Palanisamy V, et al.
Structural-mechanical characterization of nanoparticle exosomes in human saliva, using correlative AFM, FESEM, and force spectroscopy . ACS Nano . 2010;4(4):1921-1926.
🔗 https://doi.org/10.1021/nn901826n
Análise avançada das propriedades estruturais e mecânicas de exossomos em saliva humana, utilizando microscopia de força atômica (AFM) e FESEM – ideal para correlação com dados obtidos por NTA.