A Sorção Dinâmica de Vapores (DVS) tem sido amplamente utilizada para investigar a interação do vapor d'água com ingredientes farmacêuticos ativos (APIs), excipientes e formulações farmacêuticas. Esta nota de aplicação fornece uma visão geral de vários exemplos do uso do DVS em aplicações relacionadas a farmacêuticos, incluindo:
- - Higroscopicidade
- - Conteúdo de umidade
- - Transições de fase induzidas por umidade
- - Formação/perda de hidratos
- - Conteúdo amorfo
Introdução
As propriedades de sorção de vapor d'água ou umidade de materiais farmacêuticos, como excipientes, formulações de medicamentos e filmes de embalagem, são fatores críticos na determinação do armazenamento, estabilidade, processamento e desempenho das aplicações [1,2]. De acordo com a Farmacopeia dos EUA, a umidade não é tratada como uma impureza, mas a água em uma substância farmacêutica deve ser monitorada e controlada o mais rigorosamente possível (capítulo geral USP 1241). Além disso, o conteúdo de umidade afeta a cristalinidade e influencia o módulo de armazenamento, a permeabilidade, a densidade e o ponto de fusão dos produtos farmacêuticos. Em particular para materiais amorfos, a umidade pode alterar significativamente a temperatura de transição vítrea e até mesmo iniciar a transformação espontânea para a forma cristalina. Além disso, a água facilita a hidrólise e induz a degradação do medicamento. Finalmente, o conteúdo de água é rotineiramente usado para determinar o valor de ensaio seco e livre de solventes de uma substância farmacêutica [3].
Por essas razões, é desejado um método rápido, altamente sensível e automatizado para estudar as propriedades de sorção de umidade. Portanto, foi inventado o instrumento de Sorção Dinâmica de Vapores (DVS) pela Surface Measurement Systems no início dos anos 1990. Hoje, o DVS é amplamente utilizado em diversas indústrias para investigar as propriedades de sorção de vapor de sólidos, fibras, géis, partículas e materiais compostos. Esta nota de aplicação resume várias aplicações do DVS relacionadas a medicamentos, excipientes e ingredientes farmacêuticos.

DVS Instrinsic Plus - Análise de Sorção Dinâmica de Vapores de Água - Surface Measurement Systems
Método
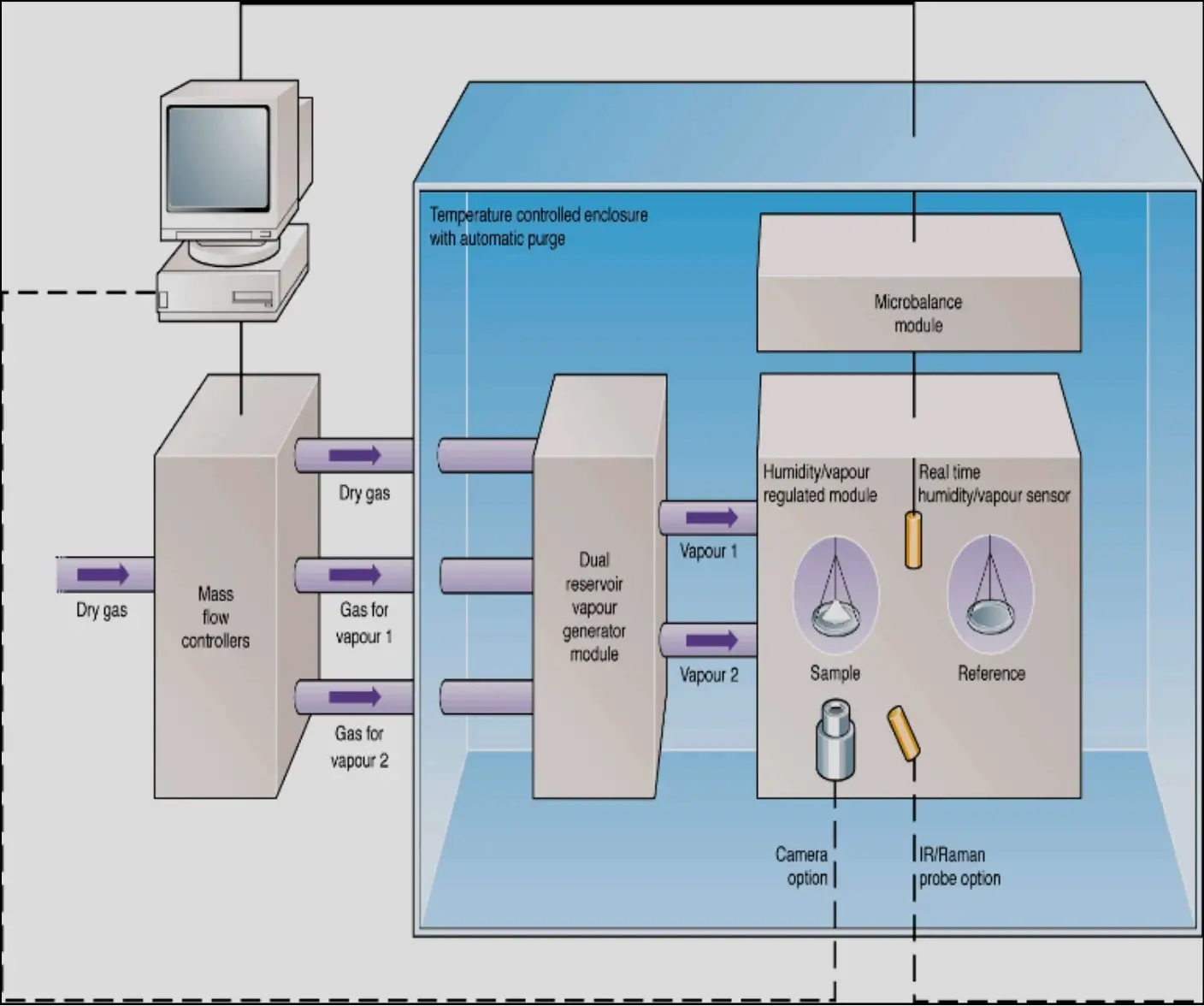
Um esquema do instrumento DVS-Advantage é mostrado na **Figura 1**. O instrumento mede a absorção e perda de vapor gravimetricamente usando o SMS UltraBalance com uma resolução de massa de ±0,1 μg. A pressão parcial de vapor ao redor da amostra é gerada pela mistura de fluxos de gás transportador saturado e seco usando controladores de fluxo de massa eletrônicos. Além de controlar a pressão de vapor d'água (ou seja, umidade relativa), o instrumento DVS-Advantage possui a capacidade única de medir e controlar ativamente a concentração de uma ampla gama de vapores orgânicos. Isso é realizado através do uso de um sensor óptico proprietário, especificamente ajustado para água e uma ampla gama de solventes. Essa tecnologia permite que o instrumento meça e controle as concentrações de vapor d'água e orgânico em tempo real.
Conteúdo de Umidade/Isoterma de Sorção
A família de instrumentos DVS tem sido rotineiramente usada para determinar isostermas de conteúdo de umidade. Isso é feito expondo a amostra a uma determinada umidade relativa até que o equilíbrio seja estabelecido. Em seguida, isso é repetido em vários passos de RH até que uma isoterma completa de sorção e/ou dessorção seja estabelecida.
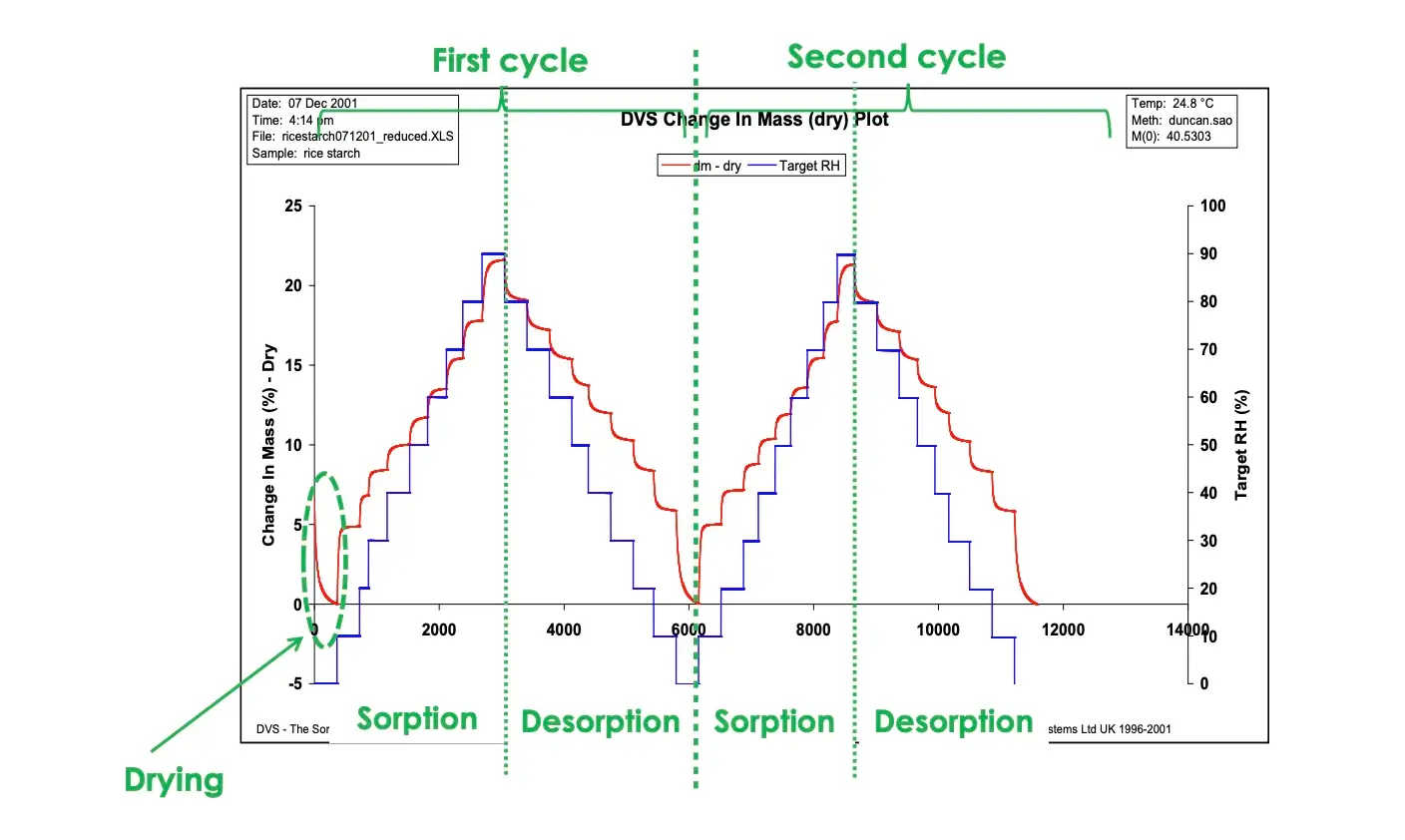
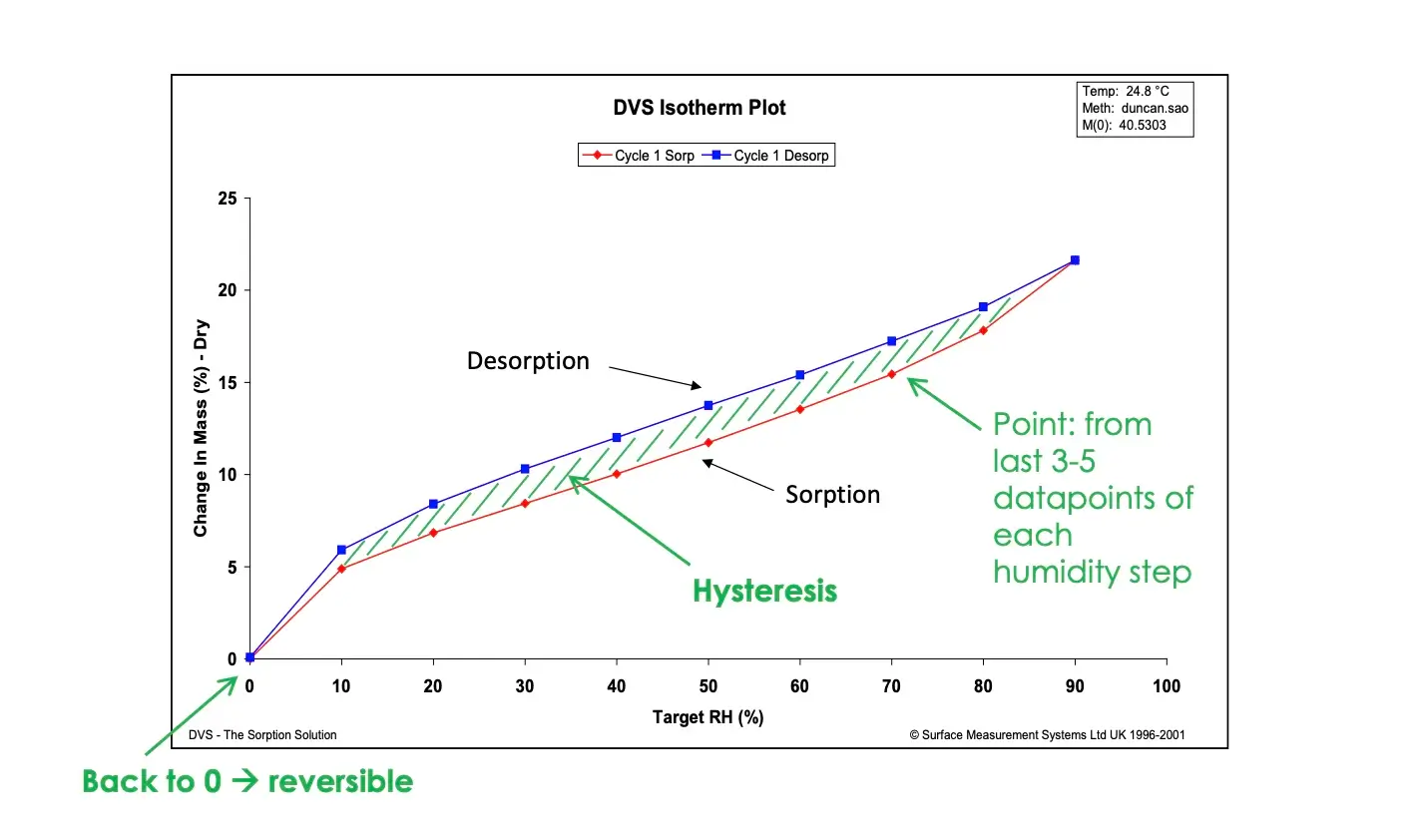
A **Figura 2** exibe a cinética típica de sorção/dessorção de umidade (a.) e isostermas (b.) para uma amostra genérica de amido.
Diferente do método do jarro dessecador, o DVS permite a medição contínua da cinética de sorção, que pode ser usada para determinar coeficientes de difusão de umidade. Isso será discutido em detalhes mais adiante. Além disso, o DVS permite a determinação de isostermas de sorção e dessorção na mesma amostra; assim, a histerese de sorção de umidade pode ser medida. Finalmente, devido ao fluxo constante de gás transportador (parcialmente) umidificado, o DVS permite que isostermas completas de sorção/dessorção sejam determinadas em horas/dias, em vez de dias/semanas/meses para o método do jarro dessecador.

DVS Adventure: Analisador de Sorção Dinâmica de Vapores - Surface Measurement Systems
Higroscopicidade dos APIs
Medir a capacidade dos sólidos de absorver vapor d'água da atmosfera a temperatura constante com mudanças na RH é frequentemente referido como uma medida de higroscopicidade. Essa medição agora é uma atividade rotineira de pré-formulação destinada a fornecer uma avaliação precoce dos possíveis efeitos da umidade nas propriedades físicas e químicas dos candidatos a medicamentos [4]. Além disso, a higroscopicidade é um dos critérios mais importantes na seleção de uma forma cristalina de medicamento para desenvolvimento. Assim, os dados de sorção de água são frequentemente utilizados durante o processo inicial de triagem de sais para identificar formas salinas/neutras cristalinas com estabilidade de umidade ‘aceitável’ [4].
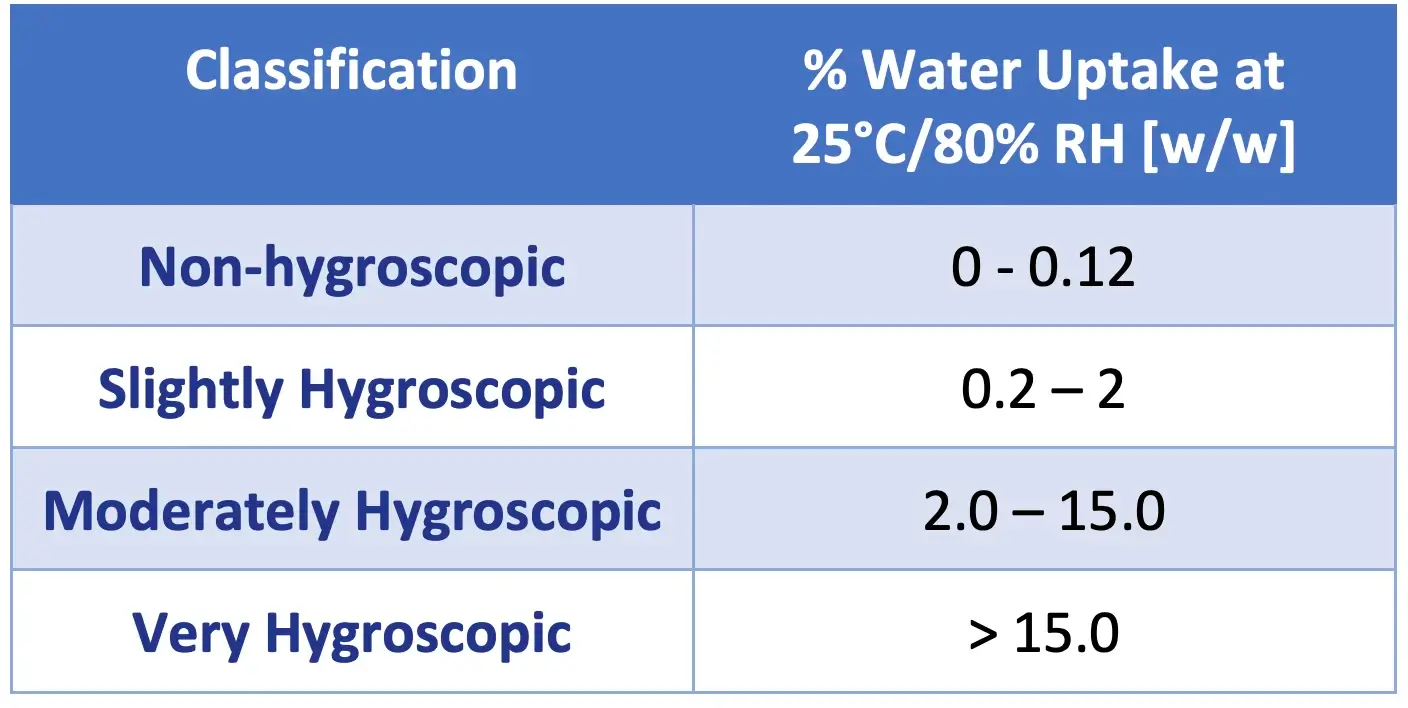
Embora a utilidade de classificar a higroscopicidade em termos de capacidades definitivas de sorção seja discutível, várias tentativas foram feitas. Além disso, é importante observar que definir a higroscopicidade é apenas o primeiro passo na avaliação dos possíveis efeitos prejudiciais da umidade nas propriedades de estado sólido de APIs e formulações. Com isso em mente, a Farmacopeia Europeia classificou a natureza higroscópica dos materiais como uma função da porcentagem de absorção de água a 25 °C e 80% RH [5].

DVS Resolution - Analisador Gravimétrico de Sorção de Vapor Dual - Surface Measurement Systems
Hidrato/Solvato
O estado final de hidratação de um material farmacêutico pode influenciar várias propriedades físico-químicas, incluindo estabilidade física e química [6]. Por exemplo, alguns materiais hidratados tornam-se amorfos após desidratação. Além disso, diferentes formas de hidrato podem afetar a solubilidade do material, a taxa de dissolução, a fluidez e a compressibilidade. Esses fatores afetam toda a cadeia do processo de desenvolvimento de medicamentos, desde a pré-formulação até o desenvolvimento da forma sólida, embalagem e armazenamento. Segundo uma estimativa, aproximadamente um terço de todos os APIs é capaz de formar hidratos cristalinos [7]. Por essas razões, houve uma pressão regulatória crescente para caracterizar e controlar completamente a forma física dos excipientes e drogas ativas [8].
O DVS pode ser utilizado para detectar e caracterizar a formação de hidratos como uma função da umidade relativa do ambiente. Informações detalhadas sobre DVS e estequiometria de hidratos podem ser encontradas na Nota de Aplicação SMS 36. Para ilustrar, a **Figura 3** mostra a isoterma de sorção de água para naloxona HCl a 25 °C. A histerese observada é típica de um hidrato estequiométrico. A amostra eventualmente sorve aproximadamente 9,6% de seu peso seco em vapor d'água. Usando o peso molecular conhecido da naloxona HCl, isso corresponde a 1,9 moléculas de água por molécula de naloxona HCl (ou seja, diidrato).
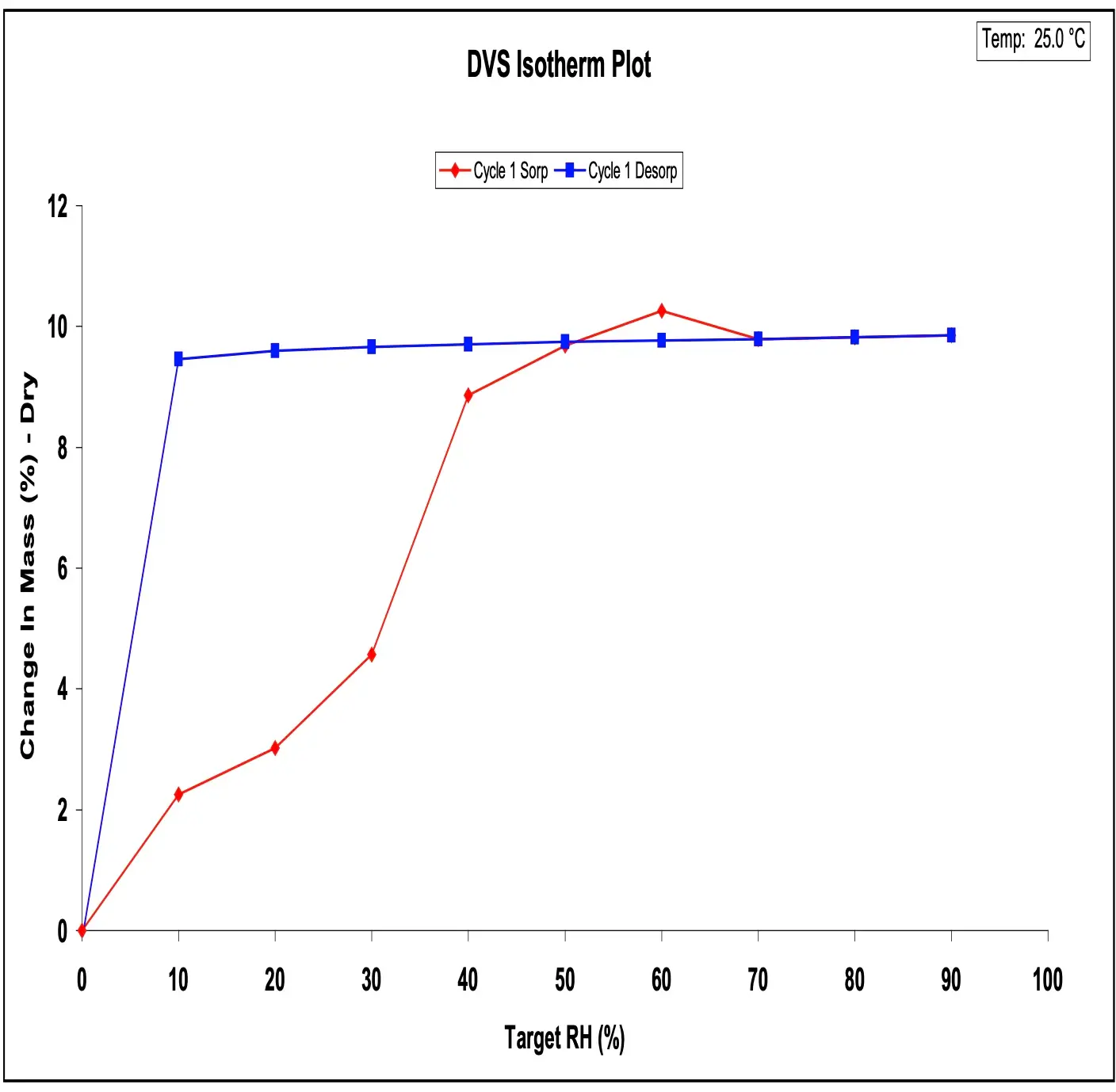
**Figura 3.** Isotermas de sorção (vermelho) e dessorção (azul) de água no diidrato de naloxona HCl a 25 °C.
Hidratos de canal são um subconjunto de hidratos farmacêuticos. Para hidratos de canal, as estruturas cristalinas hidratadas e desidratadas são isomórficas (ou seja, sem mudanças de fase distinguíveis durante a hidratação/desidratação). Em um hidrato de canal, moléculas de água preenchem canais unidimensionais ou planos bidimensionais que atravessam a estrutura cristalina. Informações detalhadas sobre o uso do DVS para identificar e caracterizar hidratos de canal podem ser encontradas na Nota de Aplicação SMS 59. A **Figura 4** mostra resultados típicos de sorção de água em um hidrato de canal. As isotermas mostram aumentos acentuados na absorção de vapor d'água abaixo de 15% RH, seguidos de uma absorção mínima de água entre 20% e 95%. A absorção de água em condições de baixa % RH se deve ao preenchimento dos canais de rede com água. Comportamento semelhante foi observado em outros contextos.
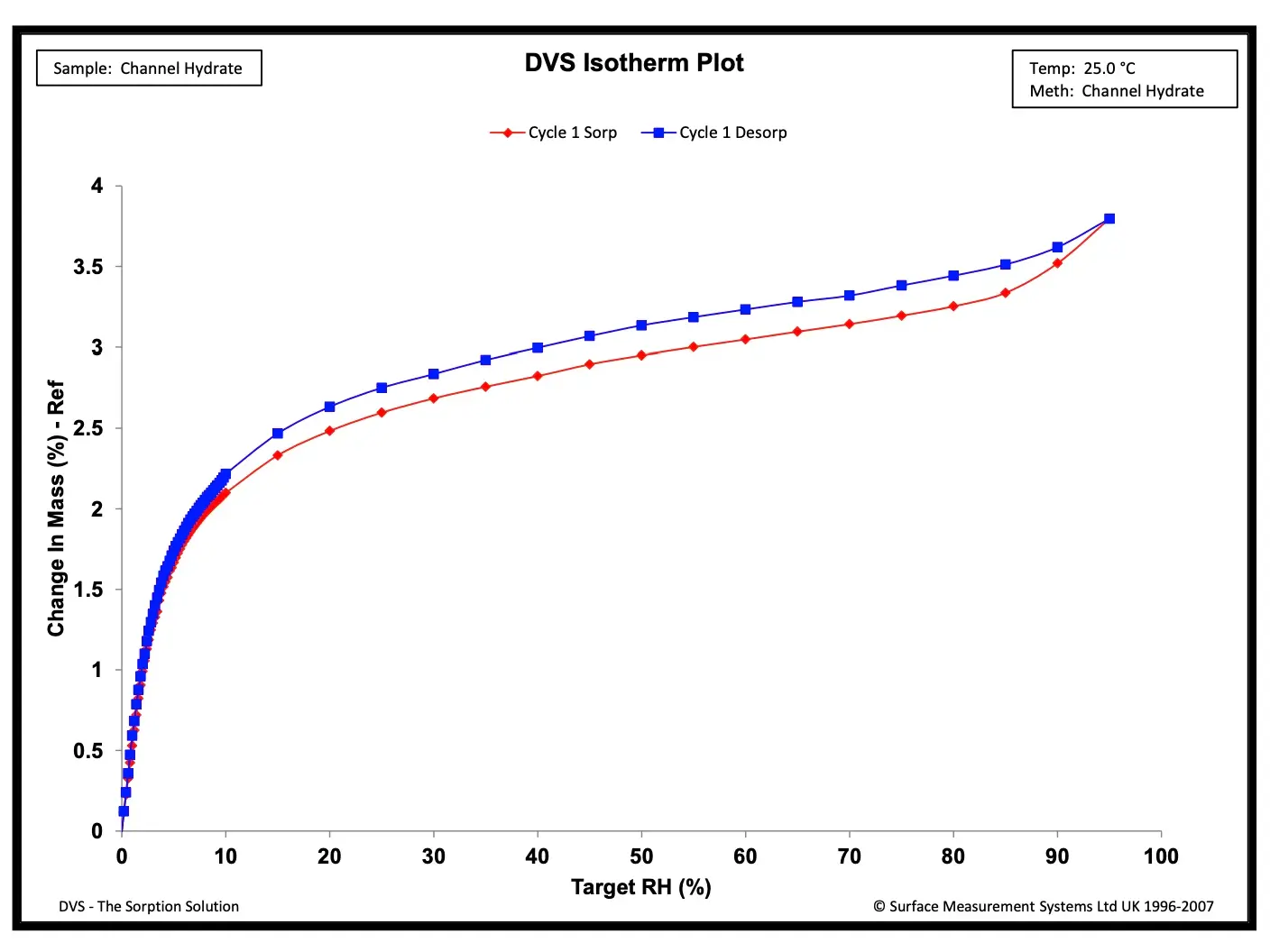
**Figura 4.** Resultados típicos de sorção de água em um hidrato de canal.
O DVS também pode ser estendido para medir as propriedades de sorção de solventes orgânicos. Portanto, a mesma metodologia pode ser usada para estudar solvatos estequiométricos. A Nota de Aplicação SMS 41 detalha essa abordagem. A Figura 5 exibe as isotermas de vapor de acetona em uma amostra de carbamazepina. A forma da isoterma e a histerese resultante indicam a formação de um solvatado 1:1 acima de 80% P/Po. Este solvatado é relativamente estável, pois não se dessolvatiza até que todo o vapor de acetona seja removido durante a etapa de secagem por dessorção.
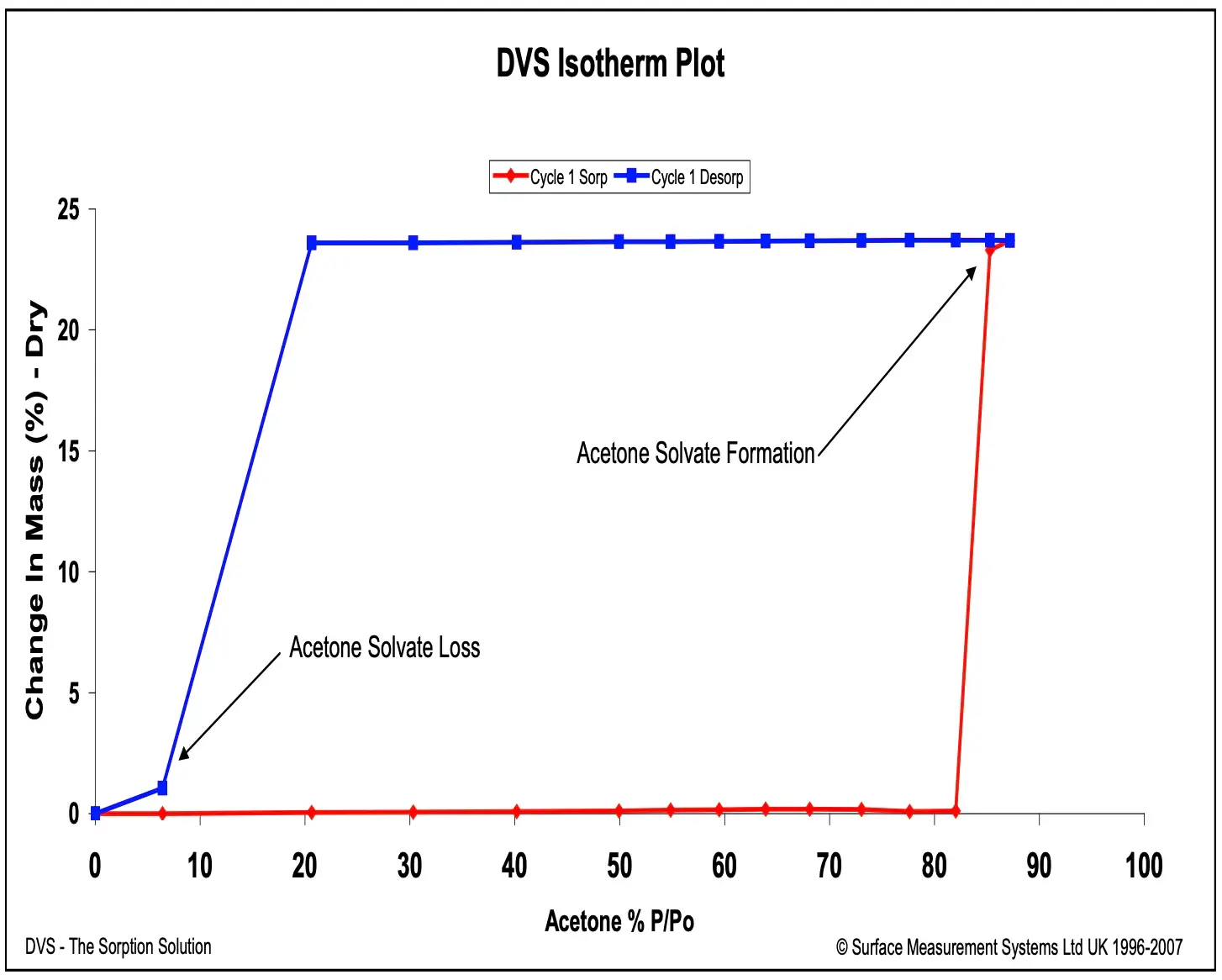
Figura 5. Isotermas de sorção (vermelho) e dessorção (azul) de vapor de acetona para carbamazepina a 25 °C.
Uma área final de caracterização na formação de hidratos/solvatados de materiais farmacêuticos é o uso combinado de DVS com espectroscopia vibracional in situ. À medida que a umidade é absorvida por uma amostra, a estrutura e as forças intermoleculares dentro dela se adaptam para acomodar as moléculas de água. Isso leva a mudanças nas características vibracionais moleculares da amostra, que podem ser monitoradas por alterações no espectro de Raman [12] ou no espectro de Near-IR [13].
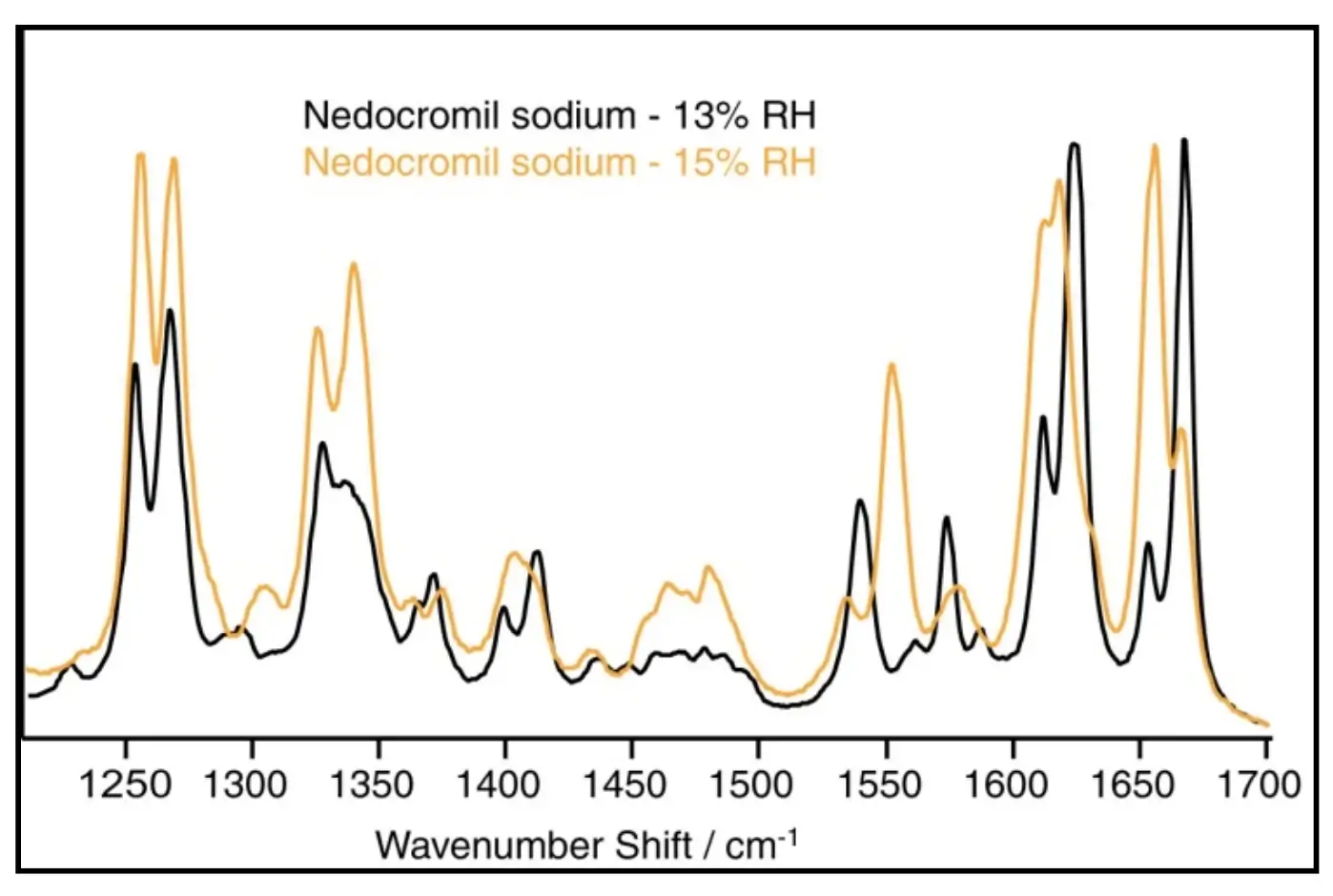
Figure 6. Raman spectra of nedocromil sodium at 13% and 15% RH.
Para ilustrar, a Figura 6 mostra os espectros de Raman para o sódio Nedocromil a 13% e 15% RH. Os dados de sorção de água do DVS nesta região indicam a absorção de dois moles de água. Os espectros de Raman confirmam a transição do estado monoidratado para o estado tri-hidratado. À medida que o composto muda seu estado de hidratação, podem ocorrer modificações substanciais em propriedades farmacêuticas importantes, como solubilidade e biodisponibilidade do medicamento. Os exemplos nesta seção ilustram como os estudos de DVS podem ser uma ferramenta poderosa na caracterização de hidratos e solvatos em uma ampla gama de concentrações de solvente e temperaturas ambientais.

DVS Discovery dual-balance gravimetric sorption analyzer - Surface Measurement Systems
Mudanças de Fase Induzidas pela Umidade
Os sólidos amorfos frequentemente absorvem quantidades relativamente grandes de vapor de água em comparação com suas fases cristalinas correspondentes. A água absorvida pode atuar como um agente plastificante, diminuindo significativamente a temperatura de transição vítrea e causando transições de fase espontâneas e colapso do liofilizado. Na verdade, muitas vezes há uma umidade crítica na qual a transição vítrea ocorrerá à temperatura ambiente. Além disso, isso pode levar a um aumento na coesividade, aglomeração do pó e adesão a outras superfícies. Para ilustrar, foi determinado que a coesividade estava relacionada aos efeitos combinados de temperatura e umidade [14]. Investigar apenas um fator (ou seja, temperatura ou umidade sozinha) não é suficiente para entender a probabilidade de um pó se aglomerar. O mecanismo de aderência e aglomeração dos açúcares amorfos ocorre por meio da mudança de fase do açúcar amorfo de um estado vítreo para um estado de borracha em condições acima do ponto de transição vítrea [14]. Portanto, determinar a temperatura e as condições de umidade necessárias para evitar uma transição vítrea é crucial para o armazenamento e processamento de ingredientes farmacêuticos amorfos.
Informações detalhadas e a teoria sobre as transições vítreas induzidas pela umidade podem ser encontradas na Nota de Aplicação SMS 32 e na Referência [15]. Em resumo, é realizado um experimento de variação linear de umidade relativa (RH), no qual várias transições de fase induzidas pela umidade podem ser identificadas pela resposta não linear de sorção de umidade da amostra. Este fenômeno é ilustrado na Figura 7 para uma amostra de lactose spray-dried.
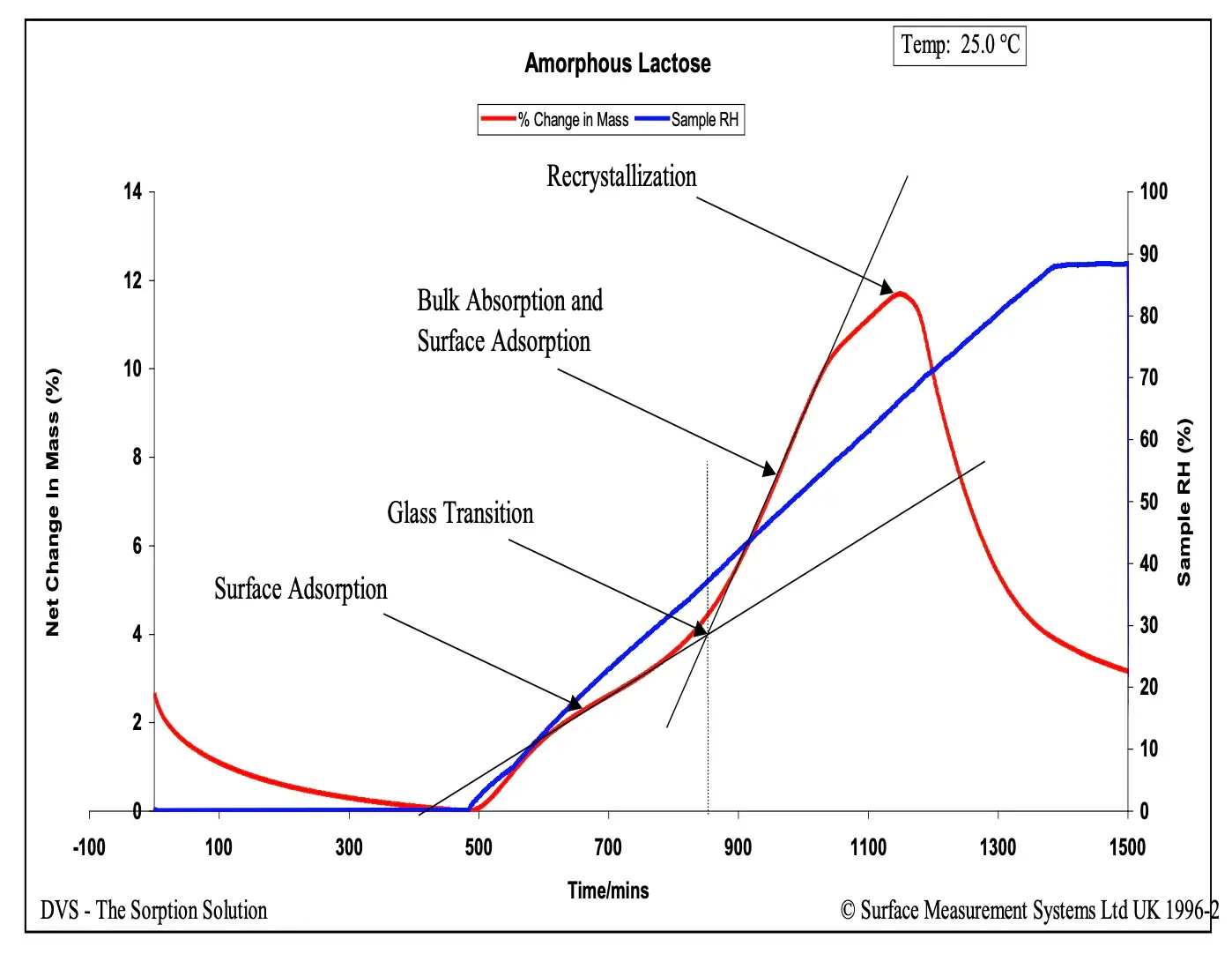
Figura 7. Experimento de variação de umidade relativa (6,0% RH/hora) para uma amostra de lactose amorfa a 25,0 °C.
Experimentos semelhantes podem ser realizados em uma faixa de temperaturas para estabelecer um diagrama de fase bidimensional (Figura 8). Isso pode ser utilizado para determinar as condições ideais de armazenamento e processamento para limitar quaisquer transformações de fase induzidas pela umidade e a subsequente aglomeração do pó.
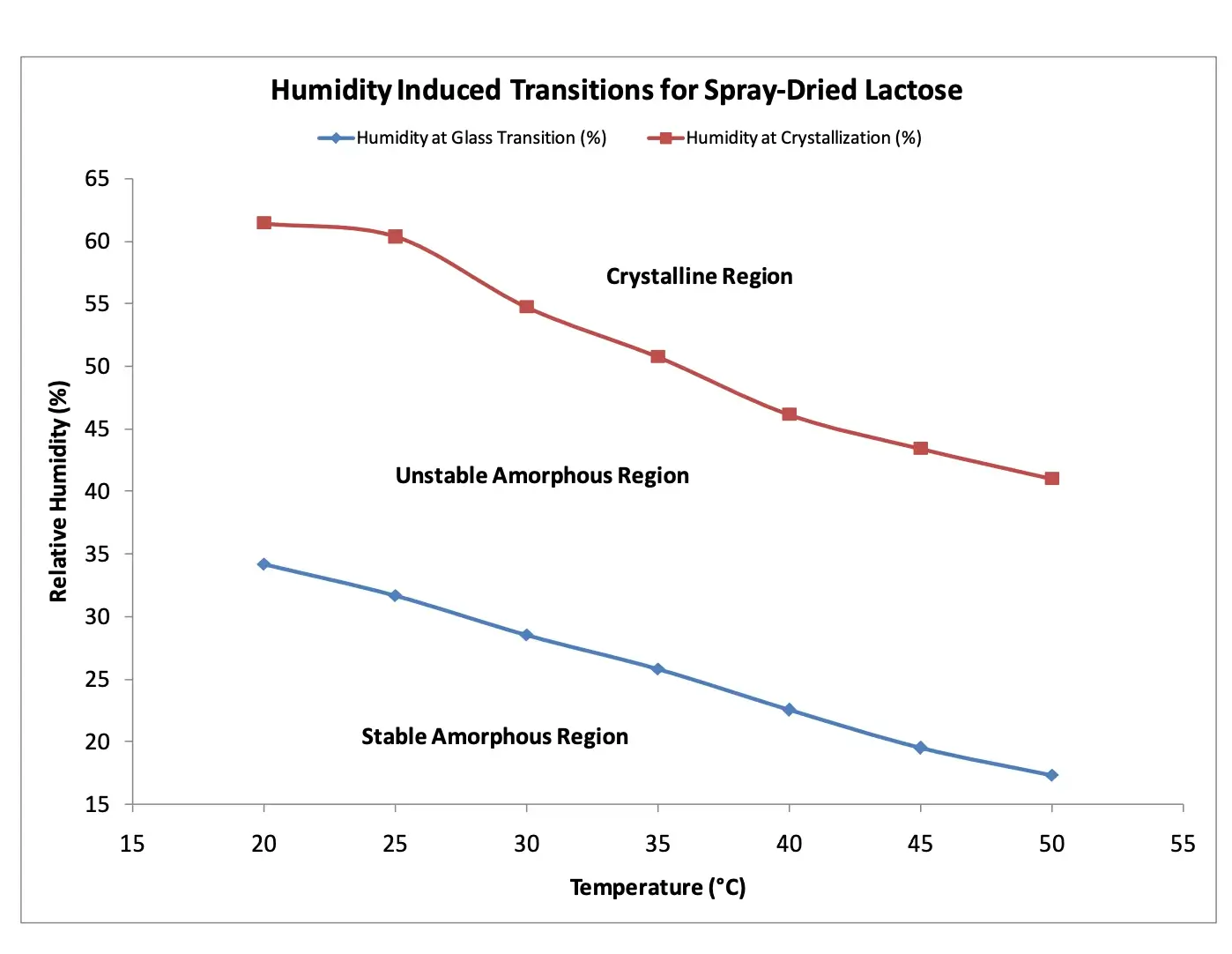
Figura 8. Transições de fase induzidas pela umidade para lactose spray-dried medidas via DVS.

DVS Endeavour - Analisador de sorção gravimétrica - Surface Measurement Systems
Conteúdo Amórfico
A presença da fase amorfa pode apresentar desafios únicos na formulação, processamento e armazenamento desses materiais. Em particular, o comportamento de aglomeração dos pós pode depender da quantidade de material presente na fase amorfa [16]. Existem vários métodos na literatura que utilizam técnicas de sorção de vapor gravimétrica para quantificar conteúdos amorfos [17,18,19,20,21]. A maioria desses métodos se baseia no fato de que a fase amorfa absorve mais vapor do que a fase cristalina. Materiais amorfos geralmente têm uma área de superfície e afinidade por vapor maiores do que seus equivalentes cristalinos. Para métodos de sorção de vapor, é tipicamente necessária uma calibração com conteúdos amorfos conhecidos. Então, a absorção de vapor em equilíbrio em uma concentração particular de vapor é plotada em relação ao conteúdo amorfo conhecido. O resultado é uma curva de calibração à qual os conteúdos amorfos desconhecidos podem ser comparados. Devido às mudanças mencionadas no estado cristalino induzidas pela água (solvatação, conversão polimórfica, etc.), recomenda-se o uso de um vapor orgânico não polar para materiais hidrofóbicos.
Para ilustrar, a Figura 9 mostra as isotermas de sorção de vapor de octano (a.) e a curva de calibração (b.) para amostras de lactose com diferentes conteúdos amorfos. As margens de erro na Figura 9b foram baseadas no 1º desvio padrão para medições repetidas (n=3).
Padrões amorfos foram criados fazendo misturas físicas de lactose 100% amorfa e lactose 100% cristalina. A curva de calibração resultante e o coeficiente de correlação (R²=0,9994) sugerem que conteúdos amorfos abaixo de 0,5% foram alcançáveis com uma precisão de ± 0,3%.
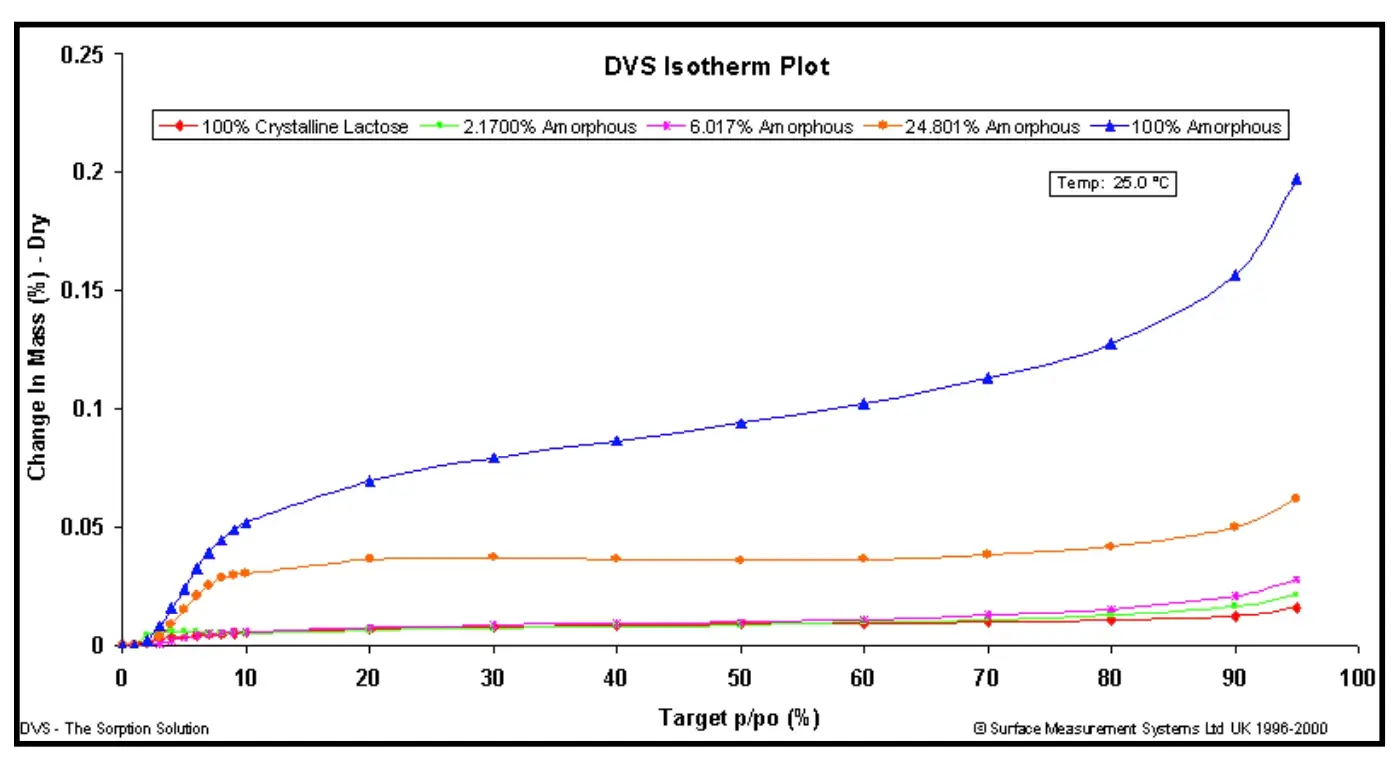
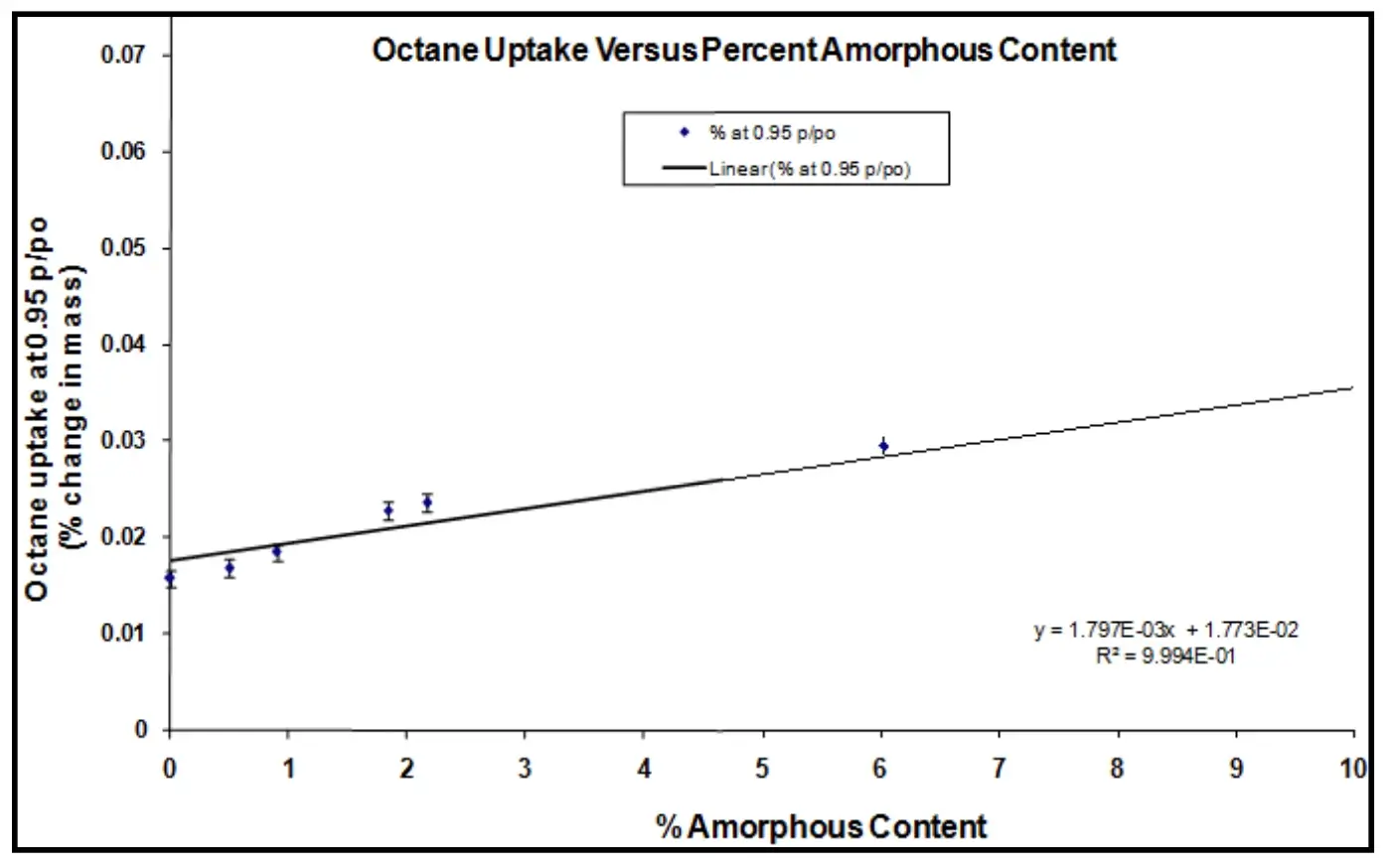
Figura 9. Isotermas de sorção de vapor de octano (a.) e a curva de calibração resultante (b.) para amostras de lactose com várias frações amorfas.
Microscopia em Vídeo
As mudanças físicas inferidas a partir dos dados gravimétricos podem ser ainda mais suportadas por imagens microscópicas in situ coletadas durante o experimento. Isso é feito utilizando o acessório DVS-Video. O microscópio digital de longa distância de trabalho permite a coleta automática de imagens durante um experimento de DVS, com ampliação de até 200X.
Figura 10 mostra imagens a 100x de lactose amorfa tomadas em 0% (A), 50% (B), 60% (C) e 90% RH (D). Este é o mesmo material utilizado na Figura 7. Aos 50% RH, a amostra claramente se transforma na forma borrachosa devido à transição vítrea induzida pela umidade. Aos 60% RH, a amostra começa a cristalizar, e aos 90% RH, a cristalização da lactose amorfa é evidente pelo aumento da opacidade da imagem. Quando combinado com a variação na massa mostrada na Figura 7, as imagens da Figura 10 identificam claramente diferentes mudanças de fase induzidas pela umidade.
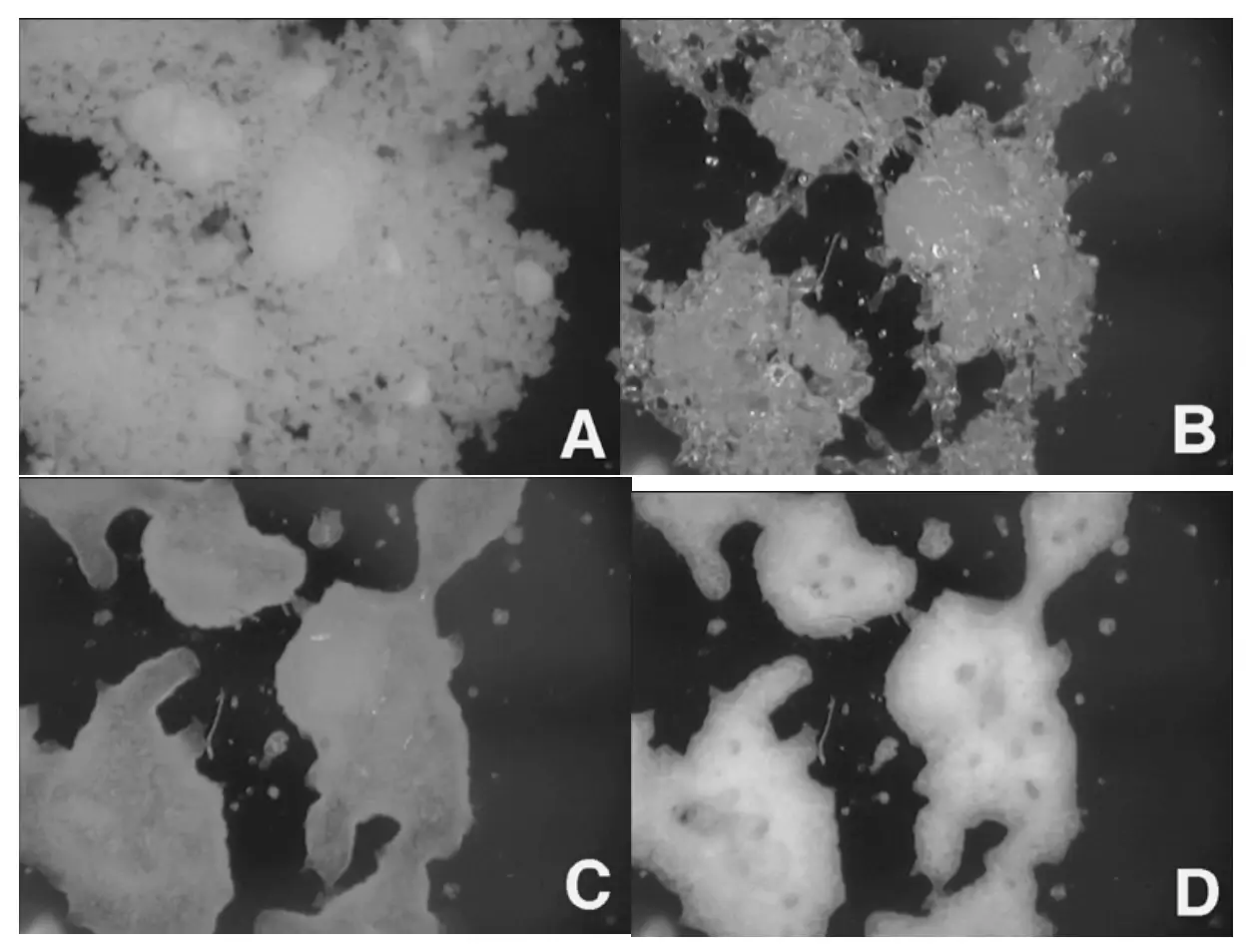
Figura 10. Imagens in-situ coletadas de lactose amorfa a 0% (A), 50% (B), 60% (C) e 90% RH (D).

DVS Carbon - Analisador de sorção gravimétrica de CO2 e H2O - Surface Measurement Systems
Raman/Near-IR
Técnicas espectroscópicas vibracionais, como Near-IR [22,23] e espectroscopia Raman [24], também foram combinadas com métodos de sorção gravimétrica. À medida que a umidade é absorvida por uma amostra, a estrutura intermolecular e as forças dentro dela se adaptam para acomodar as moléculas de água. Isso leva a mudanças nas características vibracionais moleculares da amostra, que podem ser monitoradas por alterações no espectro Raman [25] ou no espectro Near-IR [26].
Para ilustrar, a espectroscopia Raman pode ser sensível a mudanças na ligação de hidrogênio e outras reorientações sutis do material sólido. Por exemplo, a espectroscopia Raman já foi utilizada para determinar as mudanças na força da ligação de hidrogênio entre a água e diferentes polímeros farmacêuticos [27]. No mesmo estudo, foram observadas mudanças nos espectros Raman devido ao plastificante de água nos polímeros. A Figura 11 exibe a sorção/desorção de água (a.) e os espectros Raman (b.) para celulose microcristalina (MCC) a 25 °C. A MCC não deve formar uma espécie hidratada estequiométrica ou passar por qualquer mudança de fase de primeira ordem quando exposta a umidade crescente. No entanto, há diferenças claras nos espectros Raman à medida que a umidade aumenta. A MCC experimenta uma quantidade significativa de absorção de água em massa à medida que a umidade aumenta. Portanto, as mudanças observadas na Figura 11b podem ser devido ao aumento da ligação de hidrogênio, diminuição dos espaços vazios ou outras reorganizações estruturais.
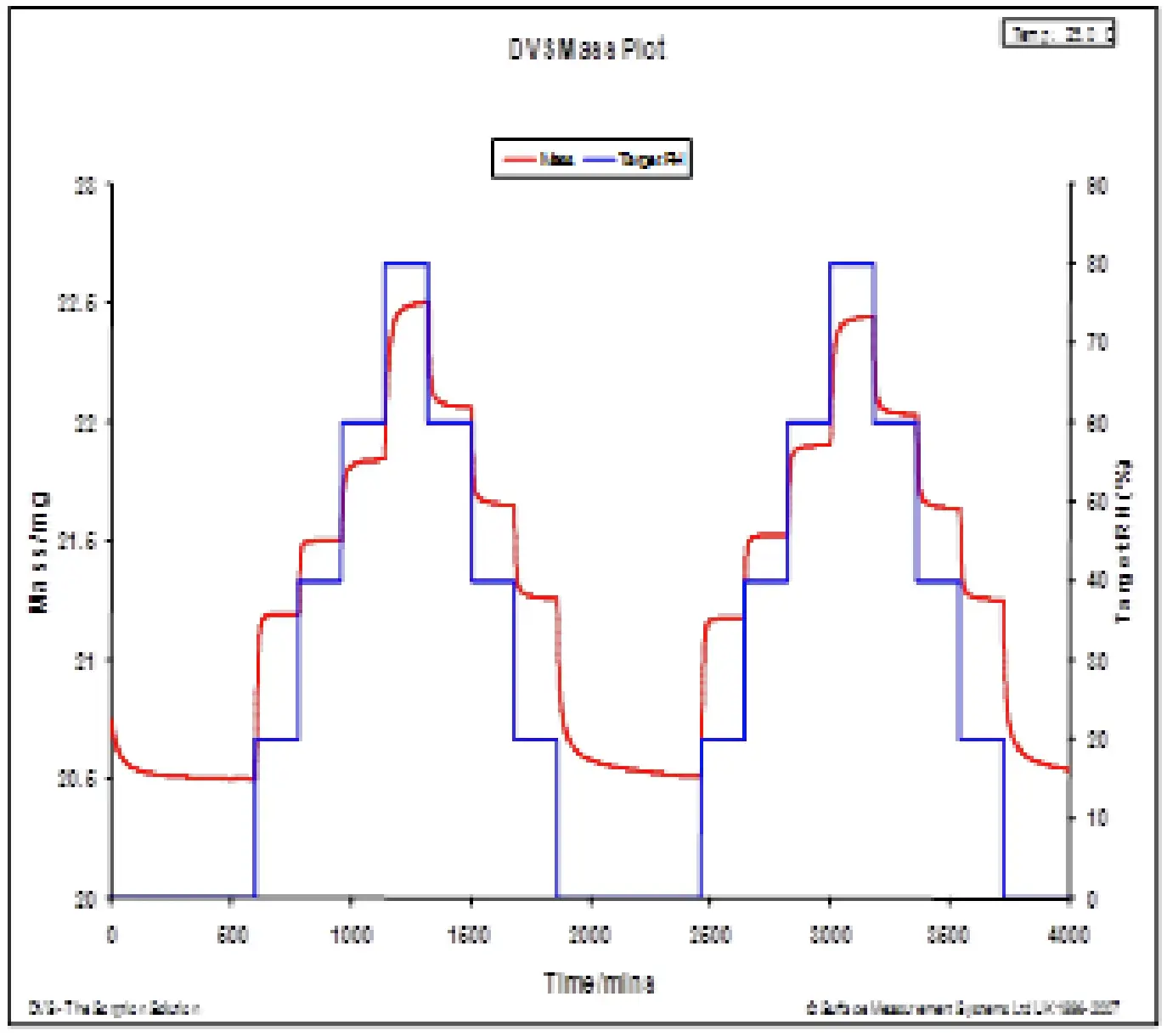
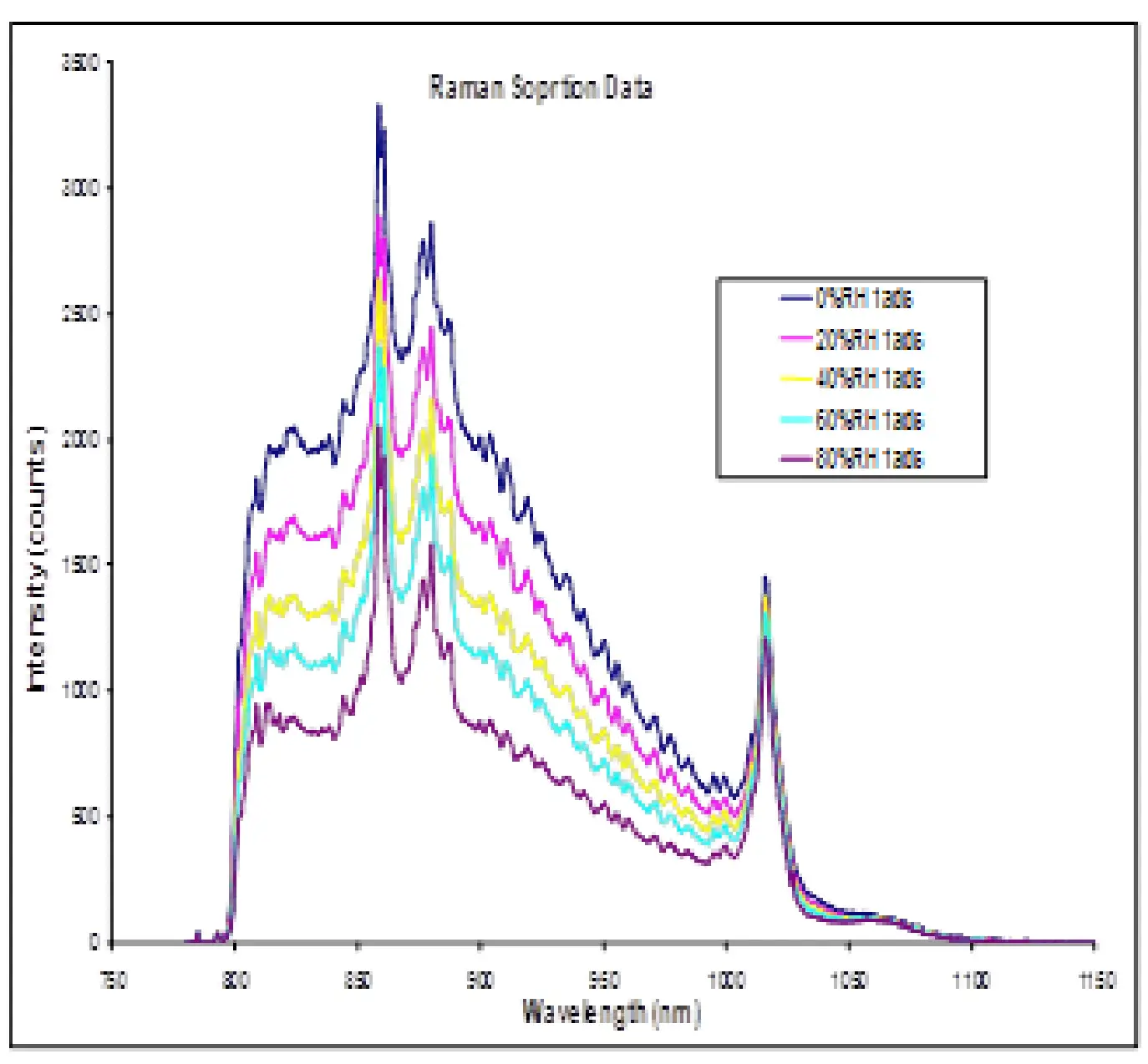
Figura 11. Resultados de sorção/desorção de água via DVS (a.) e espectros Raman in-situ (b.) para MCC a 25 °C.
Experimentos de Difusão/Fluxo
Dados de mudança de massa em tempo real podem ser coletados com a frequência de até uma vez por segundo, permitindo a determinação dos coeficientes de difusão para várias geometrias. O DVS tem sido utilizado com sucesso para medir coeficientes de difusão em filmes, pós e fibras. A difusão em filmes pode ser particularmente útil para aplicações de embalagem. A Nota de Aplicação SMS 16 descreve a teoria e o método para a determinação do coeficiente de difusão em filmes finos. Em resumo, as constantes de difusão para filmes finos utilizam equações de difusão inicialmente empregadas por Crank e Park [28]. Para um único passo de umidade e um filme fino de espessura conhecida, a cinética inicial de sorção no bulk pode ser utilizada para determinar o coeficiente de difusão. Isso pode ser realizado em uma faixa de temperaturas para investigar diferentes condições de armazenamento. A Figura 12 mostra os coeficientes de difusão de água em um filme de fluoropolímero-copolímero em uma faixa de temperaturas.
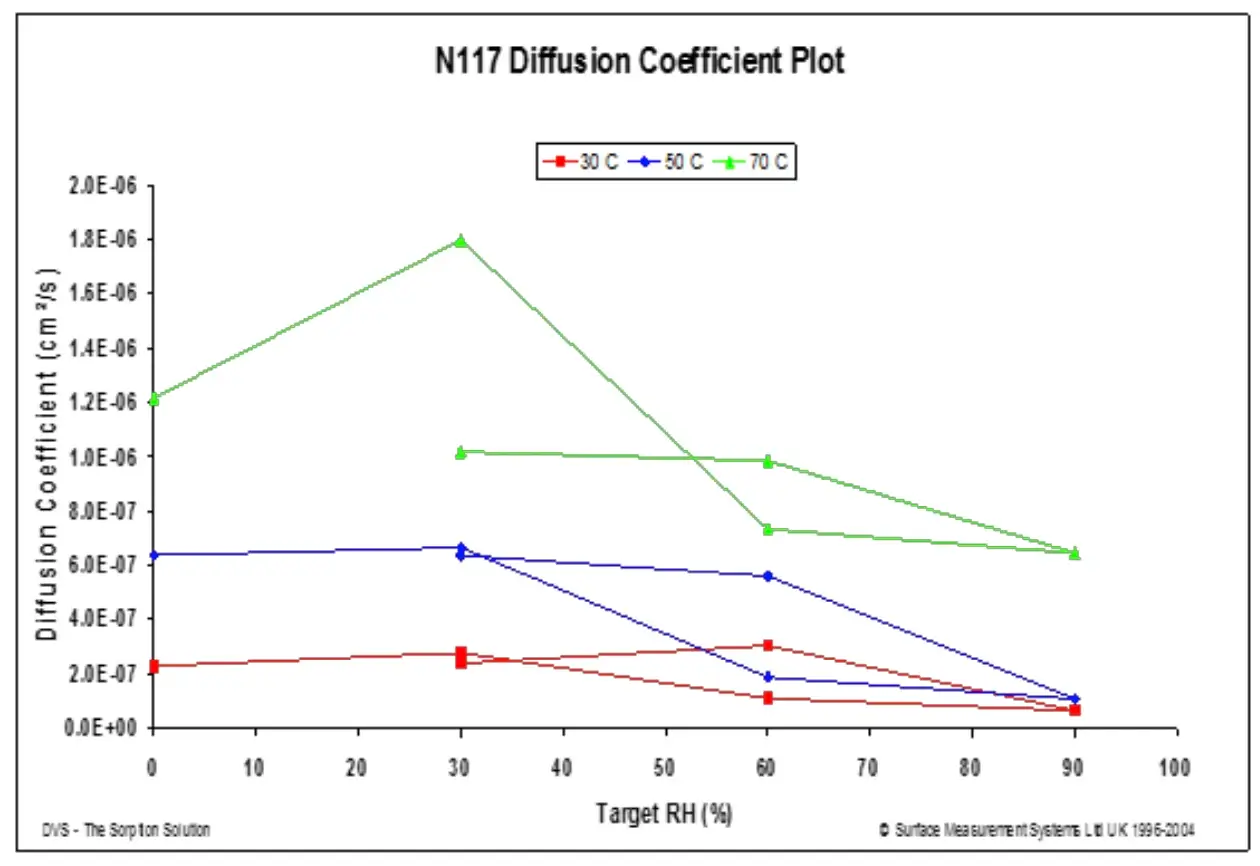
Figura 12. Coeficientes de difusão a 30 °C (vermelho), 50 °C (azul) e 70 °C (verde) para um filme de fluoropolímero-copolímero (183 micrômetros).
Taxas de Transmissão de Vapor de Água (WVTR)
Uma nova célula de difusão estilo Payne foi projetada e desenvolvida para medir a permeabilidade/taxa de difusão de um filme fino. O design dessa célula é mostrado na Figura 13. A descrição completa da célula, incluindo os métodos de copo seco e copo úmido, pode ser encontrada na Nota de Aplicação SMS 52. Esta célula pode ser prontamente usada para determinar valores de WVTR. Combinada com os coeficientes de difusão mencionados anteriormente, a determinação de WVTR pode ser utilizada para aplicações de embalagem/barreira.
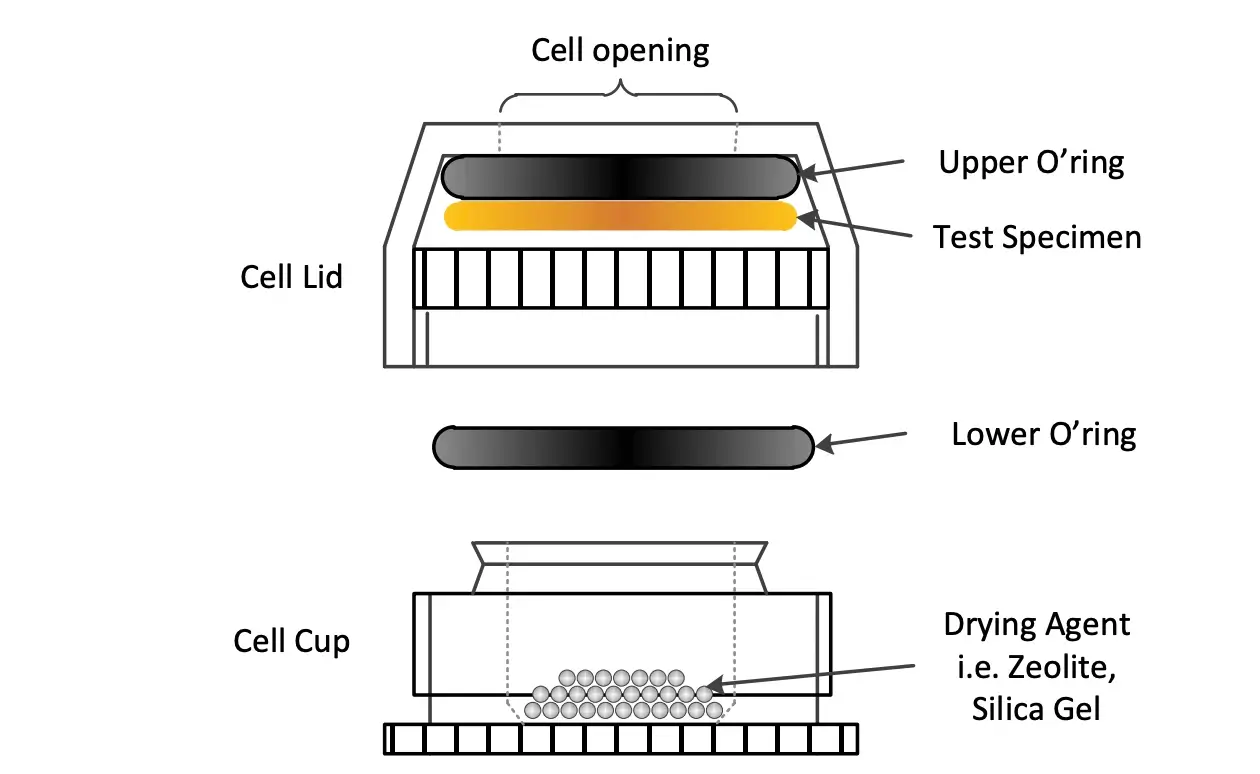
Figura 13. Montagem experimental para medição da taxa de transmissão de vapor de água.
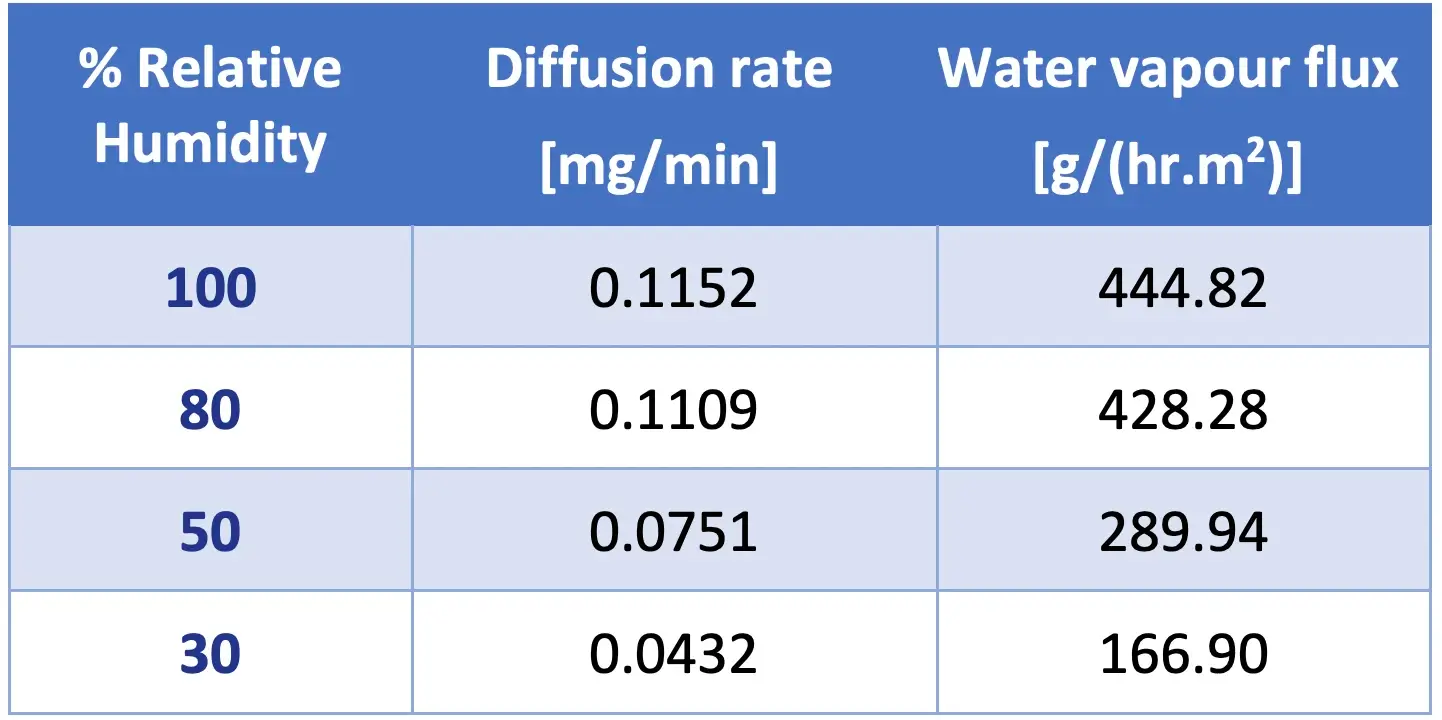
Para ilustrar a utilidade desta célula Payne, a Tabela 2 exibe os valores de fluxo de vapor de água em regime estacionário em uma membrana de PCL eletrofiada, em uma faixa de condições de umidade. Como esperado, à medida que a umidade relativa ao redor aumenta, o fluxo através da membrana também aumenta.
Table 2: Water vapour flux through electrospun PCL membrane at varying relative humidity values
Além disso, a célula Payne pode ser usada para determinar os valores de atividade da água (Aw) para uma ampla gama de materiais. Para mais informações sobre essa aplicação, consulte a Nota de Aplicação SMS 62.

DVS Vacuum Gravimetric Gas/Vapor Sorption Vacuum Analyzer - Surface Measurement Systems
Área de Superfície BET
A área de superfície BET também pode ser determinada usando vapores orgânicos no DVS. Esta abordagem é detalhada na Nota de Aplicação SMS 18. Medir áreas de superfície via DVS tem várias vantagens sobre as técnicas volumétricas tradicionais. Primeiro, os experimentos DVS são realizados à pressão atmosférica e temperatura ambiente, ao contrário do vácuo e temperaturas criogênicas, que podem alterar a estrutura de materiais frágeis (ou seja, estearato de magnésio e celulose microcristalina). Em segundo lugar, as massas de amostra necessárias para experimentos DVS (normalmente 100 mg ou menos) costumam ser muito menores do que para instrumentação volumétrica. Isso pode ser particularmente vantajoso quando as quantidades são limitadas (ou seja, novas entidades farmacêuticas) ou com materiais de área de superfície muito baixa (ou seja, abaixo de 1 m²/g). Finalmente, como o DVS é uma técnica de fluxo dinâmico, a equalização pode ocorrer com mais rapidez do que em técnicas volumétricas estáticas.
Para ilustrar, a Figura 14 mostra o gráfico BET para a sorção de octano em um fármaco hidrofóbico (Cloridrato de Metformina). Experimentos repetidos mostram que a área de superfície média foi de 0,116 ± 0,005 m²/g. Esses experimentos foram realizados com aproximadamente 450 mg de amostra. Não foi possível obter a área de superfície BET com esse tamanho de amostra relativamente pequeno usando sistemas de sorção volumétrica tradicionais com nitrogênio.
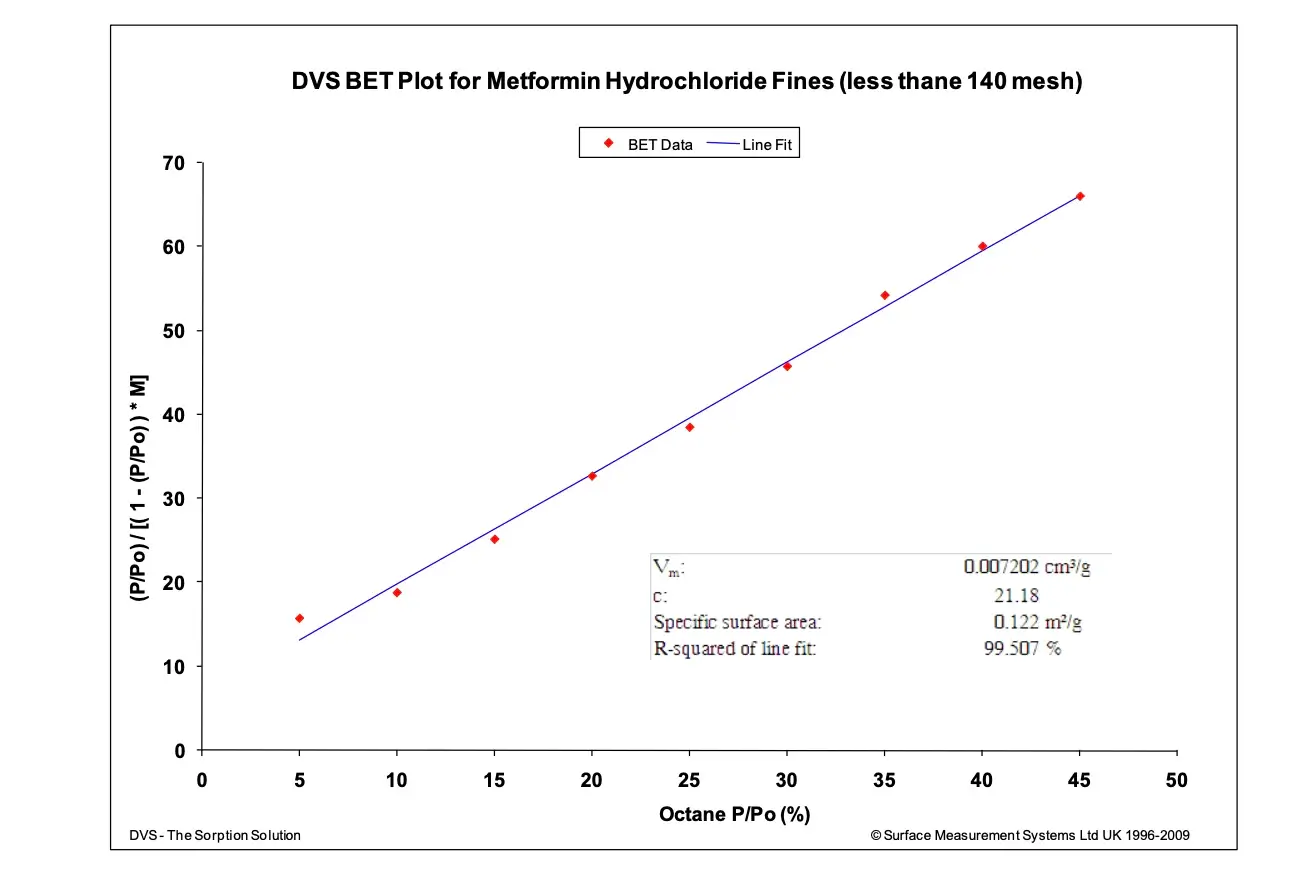
Mecanismos de Sorção
Frequentemente, é importante entender o mecanismo de sorção de vapor em materiais relacionados a fármacos para compreender melhor a interação entre vapores e materiais sólidos. Isso pode ser auxiliado pela compreensão do calor de sorção (consulte a Nota de Aplicação SMS 19) ou pela forma do isotermo (consulte a Nota de Aplicação SMS 26). As medições do calor de sorção em α-lactose monoidratada como um excipiente farmacêutico modelo, usando água e 1-butanol, são um exemplo para demonstrar informações significativas sobre o mecanismo de sorção em um sistema sólido-vapor.
Por exemplo, o isotermo de sorção de n-butanol na α-lactose monoidratada (consulte a Figura 15) indica um mecanismo de sorção do Tipo II - monoestral, seguido por sorção em múltiplas camadas. Esta forma de isotermo contrasta com a água na α-lactose monoidratada, onde resulta um isotermo do Tipo III - sem formação de monoestral. A mudança na forma do isotermo mostra uma clara mudança no mecanismo de sorção de água para n-butanol. A água é altamente polar, então as interações água-água dominam, formando ilhas ou aglomerados em baixas coberturas. Em contraste, o n-butanol é significativamente menos polar, de modo que a interação com a superfície da lactose domina em baixas coberturas, levando à formação de uma camada. Essas informações podem ser úteis na seleção de solventes como líquidos de dispersão.
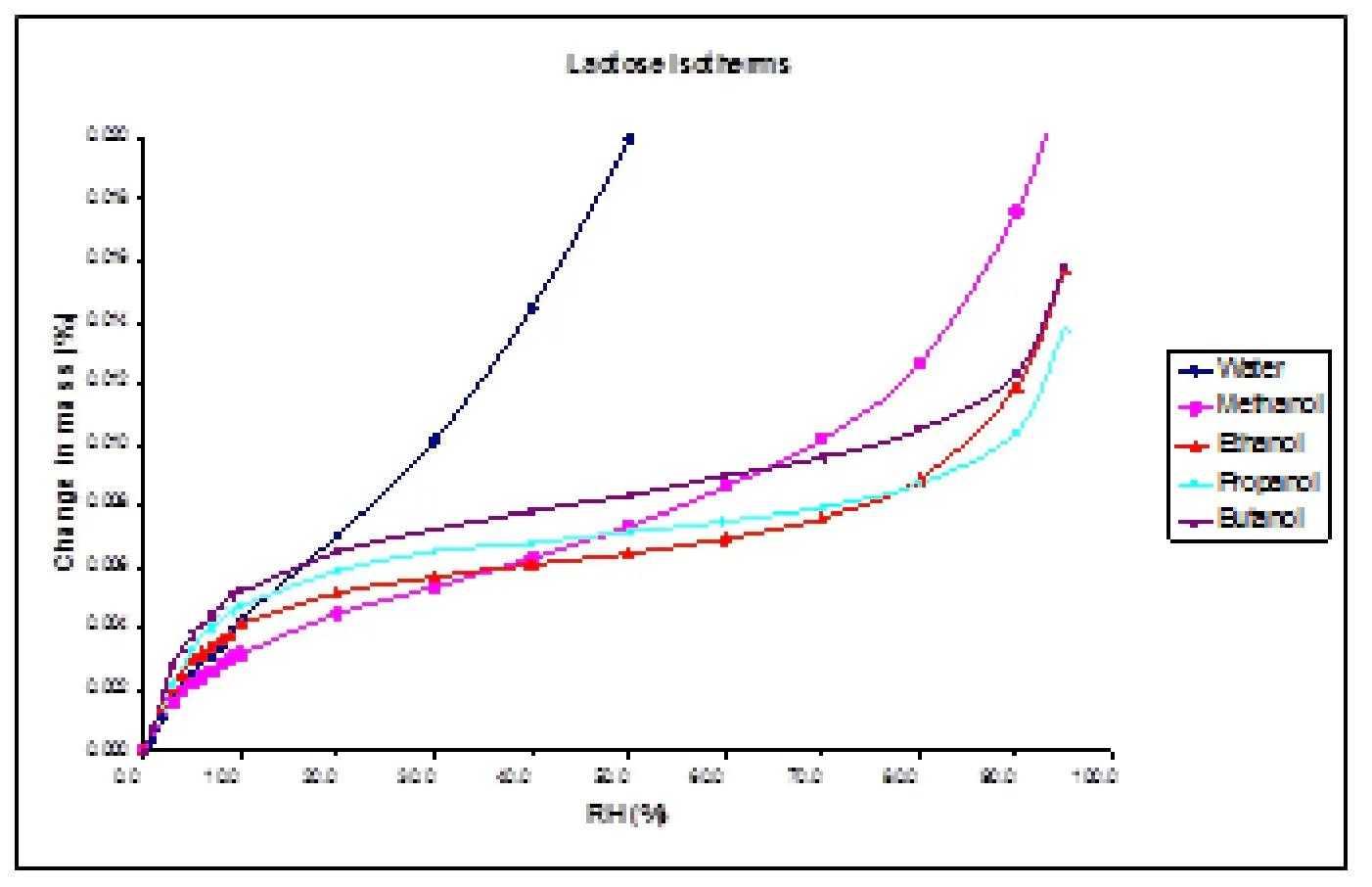
Figura 15. Isotermos de adsorção para metanol, etanol, 1-propanol e 1-butanol na amostra de lactose a 25,0 °C (com isotermo de água para comparação).
Conclusão
A utilização da funcionalidade dos instrumentos de Sorção Dinâmica de Vapor (DVS) permite estudar as características de sorção de vapor em APIs, excipientes, formulações finais, comprimidos, cápsulas e materiais de embalagem. A sorção de água nesses materiais pode ser vital para entender a estabilidade e o desempenho dos materiais. Esta nota de aplicação resumiu apenas algumas dessas aplicações, mas espera-se que ilustre como a tecnologia DVS pode ser aplicada a uma ampla gama de materiais e desafios relacionados a fármacos.
Referências
- [1] P. York. Solid-state properties of powders in the formulation and processing of solid dosage forms. Int. J. Pharm. 14, 1-28 (1983).
- [2] G. Buckton and P. Darcy, The use of gravimetric studies to assess the degree of crystallinity of predominately crystalline powders, Int. J. of Pharmaceutics, 123, 265-271 (1995).
- [3] J Sun, American Pharmaceutical Review, 14(6): 76-80 (2011).
- [4] AW Newman, SM Ruetzel-Edens, G. Zografi, Journal of Pharmaceutical Sciences, 97(3): 1047-1059 (2007).
- [5] European Pharmacopeia Technical Guide, December 1999.
- [6] Brittain, H.G. editor, Polymorphism in Pharmaceutical Solids, Marcel Dekker: New York (1999).
- [7] Braimer. D.D., editor, Towards Better Safety of Drugs and Pharmaceutical Products, Elsevier/North-Holland Biomedical Press (1980).
- [8] Office of the Federal Register. Q6A-Specifications. Test procedures and acceptance criteria for new drug substances and drug products: Chemical substances. Federal Register, Vol. 62. Washington, DC: Office of the Federal Register (1997) 62889-62910.
- [9] Vogt, F.G., Brum, J., Katrincic, L.M., Flach, A., Socha, J.M., Goodman, R.M., and Haltiwanger, R.C., Crystal Growth & Design 6 (2006) 2333-2354.
- [10] Authelin, J.-R., International Journal of Pharmaceutics 303 (2005) 37-53.
- [11] Mimura, H., Gato, K., Kitamura, S., Kitagawa, T., and Kohda, S., Chem. Pharm. Bull. 50 (2002) 766-770.
- [12] SMS Application Note 507.
- [13] Hogan, S.E. and Buckton, G., International Journal of Pharmaceutics, 227 (2001) 57-69.
- [14] KD Foster, JE Bronlund, AHJ Paterson, Journal of Food Engineering, 77:997-1006 (2006).
- [15] DJ Burnett, F Thielmann, and J Booth, International Journal of Pharmaceutic,. 287:123-133 (2004).
- [16] JJ.Fitzpatrick, M Hodnett, M Twomey, PSM Cerqueira, J O'Flynn, and YH Roos, Powder Technology, 178:119-128 (2007).
- [17] BC Hancock and G Zografi, Journal of Pharmaceutical Science, 86:1-12 (1997).
- [18] A Saleki-Gerhard, C Ahlneck, and G Zografi, International Journal of Pharmaceutics, 101 :237 (1994).
- [19] G Buckton, and P Darcy, Proc. 1st World Meeting APGI/APV, Budapest, 9/11 (1995).
- [20] L Mackin, R Zanon, JM Park, K Foster, H Opalenik, and M Demonte, International Journal of Pharmaceutics, 231 :227 (2002).
- [21] PM Young, H Chiou, T, Tee, D Traini, H-K Chan, F, Thielmann, and D Burnett,, Drug Development and Industrial Pharmacy, 33 :91-97 (2007).
- [22] RA Lane and G Buckton, International Journal of Pharmaceutics, 207:49-56 (2000).
- [23] KL Vora, G Buckton, and D Clapham, Eur. J. Pharm. Sci., 22:97-105 (2004).
- [24] AD Gift and LS Taylor, J. Pharm. And Biomedical Analysis, 43:14-23 (2007).
- [25] SMS Application Note 507.
- [26] SE Hogan and G Buckton, International Journal of Pharmaceutics, 227 :57-69 (2001).
- [27] LS Taylor, FW Langkilde and G Zografi, Journal of Pharmaceutical Science, 90:888-901 (2001).
- [28] J Crank and G. Park. Diffusion in Polymers, Academic Press New York (1968).









