O que são Probióticos e seus Benefícios para a Saúde?
Os probióticos são bactérias vivas que, acredita-se, oferecem benefícios para a saúde e efeitos biofuncionais no organismo humano. Eles são comumente usados para aumentar o número de bactérias benéficas no intestino e para regenerar a flora intestinal, especialmente após tratamentos com antibióticos. Isso explica o crescimento significativo do mercado de probióticos e suplementos alimentares probióticos. O campo de pesquisa sobre o microbioma intestinal humano e seus benefícios à saúde é particularmente importante para a indústria de nutrição.
Importância da Pesquisa sobre Técnicas de Cultivo Anaeróbico
Portanto, a pesquisa científica sobre técnicas de cultivo anaeróbico ou microaerofílico, como o cultivo de probióticos em condições semelhantes ao microbioma, é essencial. Os probióticos incluem uma ampla variedade de bactérias anaeróbicas, como Lactobacillus e Bifidobacterium . Essas bactérias desempenham um papel significativo no controle do pH, liberando ácidos lático e acético, que restringem o crescimento de muitas bactérias patogênicas potenciais.
Bifidobacterium spp. : A Bactéria Proibiótica de Maior Uso
Entre as diversas espécies de bactérias probióticas, Bifidobacterium spp. é uma das mais amplamente usadas e estudadas. Elas são classificadas como anaeróbias estritas devido à incapacidade de respiração oxigênica e crescimento sob condições aeróbicas. Além disso, são membros dominantes da microbiota intestinal humana. No trato intestinal de bebês amamentados, Bifidobacterium é a espécie predominante, representando mais de 80% dos microrganismos intestinais.
Lactobacillus : Diversidade e Potencial de Aplicação
Existem mais de 200 espécies conhecidas de Lactobacillus , o maior e mais diverso gênero dentro das bactérias do ácido láctico. Este gênero é amplamente reconhecido como seguro (GRAS) pela Administração de Alimentos e Medicamentos dos EUA (FDA). As espécies de Lactobacillus têm sido amplamente utilizadas e estudadas como culturas iniciadoras de fermentação para produtos lácteos ou como probióticos, devido ao seu potencial de saúde aplicado.
Cultivo Anaeróbico com o Microbioreator BioLector XT
Neste artigo, apresentamos experimentos de cultivo anaeróbico utilizando o microbioreator BioLector XT, em combinação com a tampa de gaseificação. O BioLector XT é um dispositivo de bancada para triagem de alto rendimento de cultivos microbianos, que permite monitoramento online dos parâmetros de cultivo mais comuns, como biomassa, valor de pH, saturação de oxigênio da fase líquida (DO) e intensidade de fluorescência de várias moléculas ou proteínas fluorescentes.
Alto Rendimento com o Sistema BioLector XT
Para alcançar alto rendimento, os cultivos são realizados em placas de microtitulagem no formato padrão SBS/SLAS, com 48 poços, permitindo a execução simultânea de até 48 cultivos no sistema do BioLector XT. Isso facilita o monitoramento eficiente e o controle preciso de múltiplos cultivos de probióticos ao mesmo tempo.
Vantagens da Tampa de Gaseificação do BioLector XT
Além disso, mostramos a simplicidade de uso da tampa de gaseificação do microbioreator BioLector XT para realizar cultivos anaeróbicos em lote e alimentados das bactérias probióticas Lactobacillus casei , Lactobacillus plantarum e Bifidobacterium bifidum . Uma das principais vantagens da tampa de gaseificação do BioLector XT é que a alimentação e o controle de pH podem ocorrer simultaneamente durante a gaseificação direta com nitrogênio (por exemplo, 100% N2) da placa de microtitulagem (MTP), com taxas de fluxo ajustáveis entre 5 e 50 mL/min.

Métodos
Cultivos Anaeróbicos de Lactobacillus spp.
Enriquecimento do Caldo MRS
Preparação das Pré-Culturas
Ajuste e Cultivo Principal
Condições Operacionais no BioLector XT
Monitoramento de Parâmetros
Detalhes das Condições de Cultivo
Tabela 1. Condições de cultivo em lote alimentado para L. casei
| Conteúdo | Configurações Microfluídicas |
|---|---|
| Reservatório a (alimentação) | 500 g/L de glicose |
| Volume da bomba: | 0,16 µL |
| Volume de preenchimento: | 1.900 µL |
| Início da alimentação: | > 7,5 h ou > 10 h |
| Alimentação constante: | 4 µL/h |
| Reservatório b (controle de pH) | NaOH 3 M |
| Volume da bomba: | 0,30 µL |
| Volume de preenchimento: | 1.900 µL |
| Início do controle de pH: | > 0,5 h |
| Configurações de PI: | MÉDIO |
| Poços de cultivo | L. casei em caldo MRS |
| Volume inicial: | 2.000 µL |
| Volume máximo: | 2.400 µL |
| Controle de pH: | pH 6,0 |
Cultivos Anaeróbicos de B. bifidum no Microbioreator BioLector XT
Todos os cultivos de Bifidobacterium bifidum (SinoPlaSan AG, Alemanha) foram realizados em caldo MRS (Carl Roth, Alemanha) a 37°C e sob condições anaeróbicas. O caldo MRS foi enriquecido com 0,5 g/L de cisteína-HCl, que serve como agente redutor para o potencial de oxidação-redução, reduzindo o O2 molecular residual no meio. Os cultivos de pré-cultura foram realizados em um frasco Erlenmeyer de 250 mL. Para isso, 20 mL de caldo MRS foram inoculados com o conteúdo de uma cápsula e cultivados por pelo menos 24 horas a 37°C sob condições anaeróbicas. A cultura principal foi ajustada para ODstart=1,0 em caldo MRS.
Para a cultura principal nos microbioreatores BioLector XT, os cultivos em lote controlados por pH e alimentados a 37°C, 600 rpm, com controle de umidade, monitoramento online de biomassa (ganho 3), pH (LG1) e DO (RF) foram realizados. Uma visão mais detalhada das condições de cultivo em lote alimentado de B. bifidum está listada na tabela 2.
Tabela 2. Condições de cultivo em lote alimentado para B. bifidum
| Conteúdo | Configurações Microfluídicas |
|---|---|
| Reservatório a (alimentação) | 500 g/L de glicose |
| Volume da bomba: | 0,16 µL |
| Volume de preenchimento: | 1.900 µL |
| Início da alimentação: | > 5 h |
| Alimentação constante: | 4 µL/h |
| Reservatório b (controle de pH) | NaOH 3 M |
| Volume da bomba: | 0,30 µL |
| Volume de preenchimento: | 1.900 µL |
| Início do controle de pH: | > 0,5 h |
| Configurações de PI: | MÉDIO |
| Poços de cultivo | B. bifidum em caldo MRS |
| Volume inicial: | 2.000 µL |
| Volume máximo: | 2.400 µL |
| Controle de pH: | pH 6,0 |
Configurações de Layout na NextGen-Microfluidic Round Well Plate

A linha A continha 1.900 µL da solução de alimentação de glicose e a linha B foi preenchida com 1.900 µL do agente de ajuste de pH. No software BioLector, os volumes das bombas foram ajustados para 0,30 µL para soluções aquosas (NaOH 3 M) e para 0,16 µL para a solução de alimentação mais viscosa (glicose 500 g/L). Em todos os experimentos de fed-batch, a alimentação foi acionada por tempo e o perfil de alimentação foi ajustado para uma alimentação constante de 4 µL/h. O controle de pH foi ajustado para pH 6,0. As condições anaeróbicas durante todas as cultivações nas NextGen-Microfluidic Round Well Plates foram alcançadas utilizando a tampa de gaseificação do microbioreator BioLector XT, que foi fixada na MTP após ser preparada e selada com o filme de silicone estéril permeável a gás (F-GPRSMF32-1).
Resultados
Cultivo em fed-batch de Lactobacillus casei no microbioreator BioLector XT
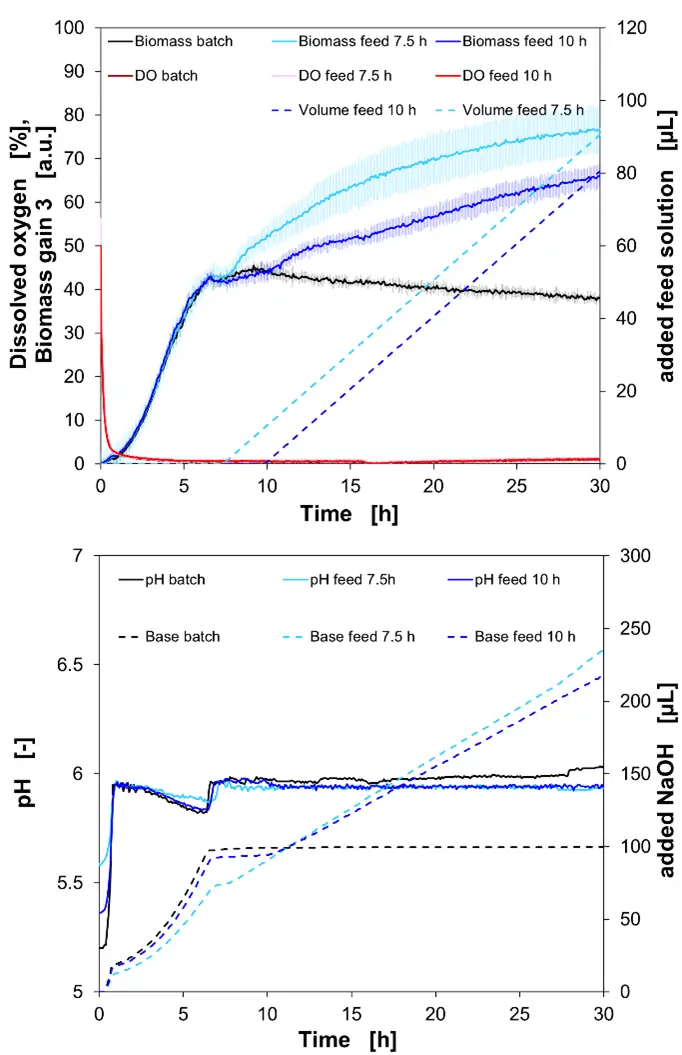
Na Figura 3, o processo de cultivo de Lactobacillus casei em caldo MRS é mostrado. No gráfico superior, são apresentados os sinais online de biomassa e oxigênio dissolvido (DO), além do volume da solução de alimentação adicionada (glicose 500 g/L). No gráfico inferior, os valores online de pH e os volumes associados de NaOH são plotados em função do tempo de cultivo.
Configurações de Processo Aplicadas
Aqui, três configurações de processo diferentes foram aplicadas: um cultivo em batelada e dois cultivos em fed-batch. Um com início de alimentação após 7,5 horas e o outro com início de alimentação após 10 horas.
Aqui, três configurações de processo diferentes foram aplicadas: um cultivo em batelada e dois cultivos em fed-batch. Um com início de alimentação após 7,5 horas e o outro com início de alimentação após 10 horas.
Diminuição Contínua do DO
Com uma taxa de fluxo contínuo de 30 mL/min de N2, o DO diminuiu de forma constante. Após 45 minutos, o DO ficou abaixo de 5% e continuou a cair. Após 4,5 horas, o DO ficou abaixo de 0,5% e continuou a cair em direção a 0%.
Fase Estacionária e Crescimento Exponencial
Com o início da fase estacionária da cultura por volta de 6,7 horas, o crescimento exponencial parou, e o sinal de biomassa era de 42 a.u. em todas as três abordagens culturais neste ponto de tempo. O cultivo em batelada cresceu lentamente até um máximo de 44 a.u. às 9,5 horas, depois diminuiu constantemente até um sinal final de biomassa de 38 a.u. no final do cultivo.
Relação entre Alimentação e Crescimento
Um aumento no sinal de biomassa é correlacionado com a adição da solução de alimentação. Assim que a alimentação começa, um aumento no sinal de biomassa é visível. O sinal final de biomassa para o processo de fed-batch de 7,5h foi de 76,3 a.u. e para o processo de fed-batch de 10h, levou a um sinal final de biomassa de 65,5 a.u. após 30 horas.
Controle de pH durante o Processo
Os valores para a solução de base adicionada são correlacionados ao crescimento. A adição de NaOH 3M foi interrompida com o início da fase estacionária porque não ocorreu mais produção bacteriana de ácidos devido à ausência de crescimento. No caso da solução de alimentação com adição constante, a produção de ácidos continuou e, portanto, a base foi necessária para manter o ponto de controle de pH de 6.0.
Em resumo, este experimento mostra que o microbioreator BioLector XT é um dispositivo adequado para cultivos anaeróbicos devido à sua tampa de gaseificação e à aplicação bem-sucedida de controle de pH e alimentação simultaneamente com gaseificação anaeróbica direta.
Validação técnica e biológica das condições anaeróbicas no dispositivo BioLector XT microbioreactor
Manter as condições anaeróbicas durante todo o tempo de cultivo é um requisito importante no caso do cultivo de organismos sensíveis ao oxigênio. No experimento a seguir, um sensor de oxigênio externo (FTM Pst6 Sensor/Fibox 4 trace, PreSens Precision Sensing GmbH, Alemanha) foi instalado na saída de gás do BioLector XT microbioreactor para validar a funcionalidade técnica da tampa de gaseificação e provar a estanqueidade da tampa de gaseificação e, assim, a atmosfera anaeróbica.
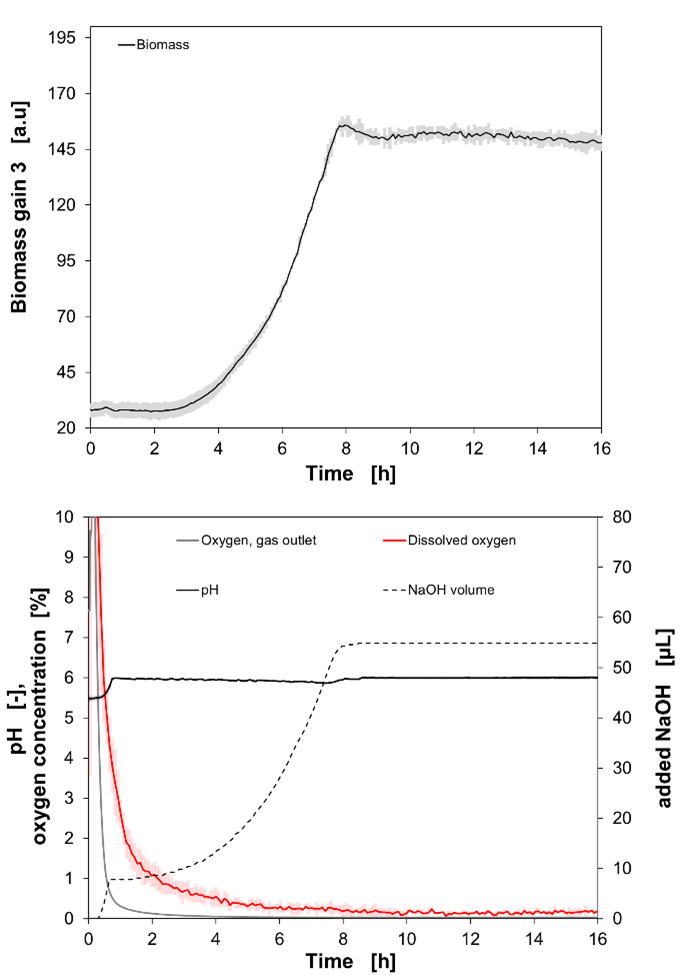
Na Figura 4, os dados experimentais de um cultivo em batelada de Lactobacillus plantarum (L. plantarum) são mostrados. No gráfico superior, o sinal online de biomassa é mostrado (ganho 3), e no gráfico inferior, o sinal online de oxigênio dissolvido no caldo de cultura e a concentração de oxigênio na saída de gás do BioLector XT microbioreactor, o sinal de pH online, bem como o volume de NaOH adicionado para o controle de pH são mostrados.
Após um tempo de atraso de 2,86 horas, o crescimento exponencial começou. O sinal final de biomassa foi de 155,865 a.u. (OD600 = 9,01 ± 0,07) após 7,96 horas, quando a fase estacionária foi iniciada. Durante o crescimento de L. plantarum , ocorreu a produção de ácido láctico. Essa formação de ácido é correlacionada ao volume de NaOH adicionado para manter o pH 6. Com uma taxa de fluxo contínuo de 30 mL/min de N2, o DO diminuiu de forma constante.
Diminuição do DO durante o Cultivo
Após 39 minutos, o DO abaixo de 5% foi alcançado e continuou a diminuir. Após 4 horas, o DO caiu ainda mais abaixo de 0,5% e continuou a cair em direção a 0%. O sensor externo mostrou uma concentração final de oxigênio de 0,029% após 16 horas de cultivo.
Validação Técnica do Cultivo
Com este exemplo de cultivo, a funcionalidade técnica foi validada, mas o fato de Lactobacillus spp. também poder crescer em condições aeróbicas e até metabolizar oxigênio não é evidência suficiente para a validação biológica do cultivo anaeróbico no microbioreator BioLector XT.
Validação Biológica com Bifidobacterium bifidum
Portanto, o estrito Bifidobacterium bifidum anaeróbico foi cultivado. O cultivo bem-sucedido dessa cepa serve como a validação biológica para cultivos anaeróbicos no microbioreator BioLector XT.
Dados Experimentais do Cultivo
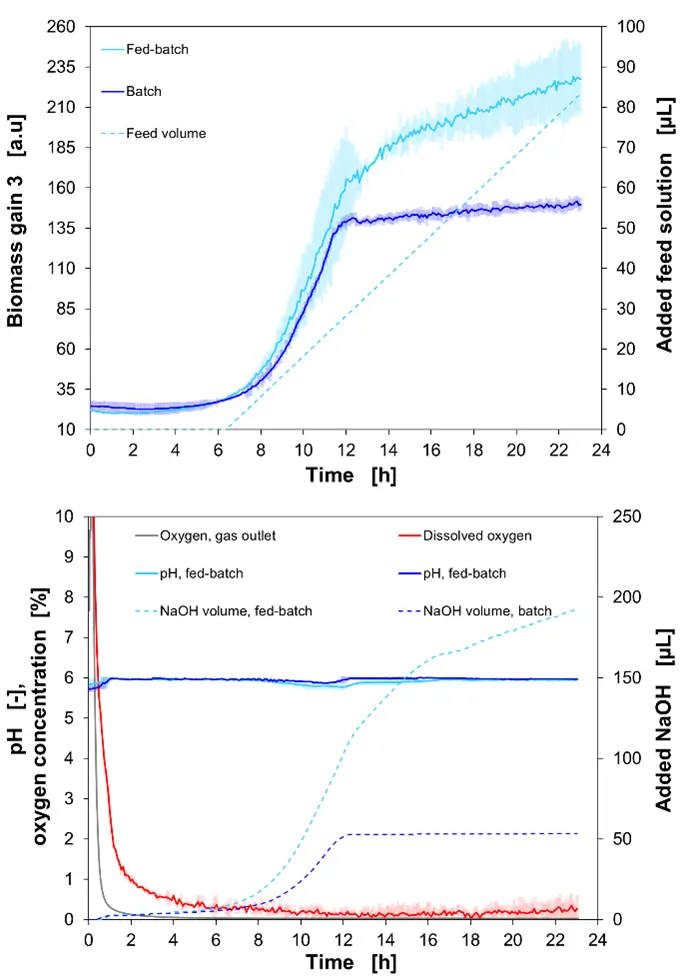
Na Figura 5, os dados experimentais de um cultivo em batelada, bem como de um cultivo em fed-batch de B. bifidum, são mostrados. No gráfico superior, os sinais online de biomassa e o volume de alimentação adicionado são plotados em relação ao tempo de cultivo. No gráfico inferior, o sinal online (optodes) de pH e DO, bem como o volume adicionado de 3 M NaOH e o sinal de oxigênio do sensor externo de gás na saída de gás do BioLector XT, são apresentados.
Início do Crescimento Exponencial
Após um tempo de latência de 2,4 horas, o crescimento exponencial iniciou e, para o cultivo em batelada, o sinal de biomassa atingiu um valor final de 147,57 a.u. (OD600 = 8,3 ± 0,57). Em contraste com o cultivo em batelada, foi observada uma fase de crescimento exponencial estendida. Esse fenômeno foi causado por uma maior quantidade de glicose no meio, já que a alimentação foi iniciada após 6 horas. Após 23 horas de cultivo, o valor máximo de biomassa alcançado foi 227,3 a.u. (OD600 = 15,93 ± 0,69).
Produção de Ácido Lático e Controle de pH
Durante o crescimento de Bifidobacterium bifidum , a produção de ácido lático ocorreu, e seu crescimento foi correlacionado com a curva de adição de NaOH para manter o pH em 6. No total, 193,56 µL de NaOH 3 M foram adicionados à cultura.
Variação do DO e Vazão de Nitrogênio
Com uma vazão contínua de 30 mL/min de N2, o DO (oxigênio dissolvido) diminuiu de forma constante. Os dados de oxigênio externo, já descritos para as primeiras 16 horas do cultivo de Lactobacillus plantarum e Bifidobacterium bifidum , foram obtidos simultaneamente na mesma corrida de microbioreator BioLector XT. O mesmo MTP, tampa de gaseificação e sensor de gás externo foram utilizados.
Sinal de DO e Deriva Técnica
É possível observar que o sinal de DO aumentou ligeiramente após 18 horas, o que pode ser explicado pela deriva técnica do sinal dos optodos de oxigênio, com uma deriva de < 0,5% O2 por dia em 0% de oxigênio. Os dados do sensor externo de oxigênio mostraram um valor de 0,029% de oxigênio na saída de gás do microbioreator BioLector XT após 23 horas, confirmando que as condições anaeróbicas foram mantidas durante todo o tempo de cultivo.
Validação Biológica e Técnica do Cultivo Anaeróbico
Em conclusão, demonstramos um experimento de cultivo bem-sucedido de um organismo anaeróbico no microbioreator BioLector XT. Combinado com a tecnologia de chip microfluídico da m2p-labs e a gaseificação direta de nitrogênio através da tampa de gaseificação, a execução simultânea do controle de pH, alimentação e gaseificação direta de nitrogênio não é mais um desafio em cultivos em pequena escala.
Conclusão Geral
Em resumo, mostramos a validação técnica e biológica do cultivo de probióticos como Lactobacillus spp. e Bifidobacterium bifidum no microbioreator BioLector XT, em combinação com sua tampa de gaseificação anaeróbica. A tecnologia de chip microfluídico da m2p-labs, combinada com a gaseificação direta de nitrogênio do MTP através da tampa de gaseificação, permite a execução simultânea do controle de pH, alimentação e gaseificação direta de nitrogênio em sistemas de cultivo em pequena escala. Este é um sistema adequado para o cultivo de bactérias anaeróbicas.
Referências
- Ku S, Park MS, Ji GE, You HJ. Review on Bifidobacterium bifidum BGN4: Functionality and nutraceutical applications as a probiotic microorganism. Int J Mol Sci. 2016;17(9):1544. Link
- Shimamura S, Abe F, Ishibashi N, Miyakawa H, Yaeshima T, Araya T, Tomita M. Relationship between oxygen sensitivity and oxygen metabolism of Bifidobacterium Species. Journal of Dairy Science, 1992, 75(12): 3296-3306. Link
- Sakurai T, Yamada A, Hashikura N, Odamaki T, Xiao JZ. Degradation of food-derived opioid peptides by bifidobacteria. Benef Microbes. 2018; 9(4):675-682. Link
- Hidaka H, Eida T, Takizawa T, Tokunaga T, Tashiro Y. Effects of Fructooligosaccharides on intestinal flora and human health. Bifidobacteria Microflora . 1986, 5(1), 37-50. Link
- Kato K, Odamaki T, Mitsuyama E, Sugahara H, Xiao JZ, Osawa R. Age-related changes in the composition of gut Bifidobacterium species. Curr Microbiol. 2017;74(8):987-995. Link
- Hill D, Sugrue I, Tobin C, Hill C, Stanton C and Ross RP (2018) The Lactobacillus casei group: History and health-related applications. Front. Microbiol. 9:2107. Link


.webp)