O que são biorreatores e como selecionar o equipamento adequado
Biorreatores são sistemas controlados que fornecem ambiente otimizado para cultivo de microrganismos ou células, com monitoramento preciso de parâmetros como pH, oxigênio dissolvido (DO), temperatura e agitação. A seleção adequada impacta diretamente o rendimento do bioprocesso, podendo variar em até 50% devido a heterogeneidades em gradientes de nutrientes , segundo estudos de modelagem computacional de biorreatores industriais.
O mercado global de biofármacos segue em expansão, impulsionado por anticorpos monoclonais, vacinas e terapias avançadas (US$ 474-666 bilhões em 2025, projeções US$ 816-1.411 bilhões até 2033-2034, CAGR 6,55-8,6% segundo Fortune Business Insights e Grand View Research ). A escolha entre biorreatores de bancada, escala piloto ou plantas industriais define a viabilidade de processos desde P&D até produção GMP.

A seleção inadequada de biorreatores compromete transferência de oxigênio, homogeneidade de mistura e escalabilidade, resultando em perdas significativas de rendimento durante scale-up.
Este guia aborda os critérios técnicos fundamentais para seleção de biorreatores, organizado por escalas de volume e aplicações específicas:
- Microescala e alto rendimento para screening inicial
- Biorreatores de bancada para desenvolvimento laboratorial
- Escala piloto para validação e transição produtiva
- Plantas industriais para produção em larga escala
- Comparação técnica entre modelos e critérios de decisão
Critérios técnicos para seleção de biorreatores
A escolha do biorreator adequado fundamenta-se em quatro critérios principais: escala de volume, tipo de cultivo, parâmetros de controle e requisitos regulatórios. Cada critério influencia diretamente a configuração do equipamento e sua adequação ao estágio de desenvolvimento.
A escala de volume define a categoria do equipamento: laboratorial (<10 L), piloto (10-1000 L) e industrial (>1000 L). O tipo de cultivo diferencia sistemas para microrganismos (bactérias e leveduras com alta demanda de oxigênio) de sistemas para células eucarióticas (sensíveis a cisalhamento). Os parâmetros controlados incluem faixas típicas de pH (2-12), DO (0-300%), temperatura (4-80°C) e agitação (30-2800 rpm).
Requisitos GMP para produção clínica exigem sistemas com esterilização SIP (Steam-In-Place) e CIP (Clean-In-Place), rastreabilidade completa e validação de processos.
Microbiorreatores para screening de alto rendimento
Sistemas de microescala permitem cultivos paralelos em volumes de microlitros, acelerando a otimização de condições de crescimento e seleção de cepas. O monitoramento óptico não invasivo em tempo real quantifica biomassa, pH e oxigênio dissolvido sem necessidade de amostragem destrutiva.
A tecnologia microfluídica integrada possibilita controle individual de gaseificação e alimentação contínua para cada poço, viabilizando processos fed-batch aeróbicos e anaeróbicos. Estudos demonstram correlação alta de kLa (coeficiente de transferência de oxigênio até 500 h⁻¹) com biorreatores de bancada, reduzindo experimentos necessários para scale-up.
BioLector XT - Beckman Coulter
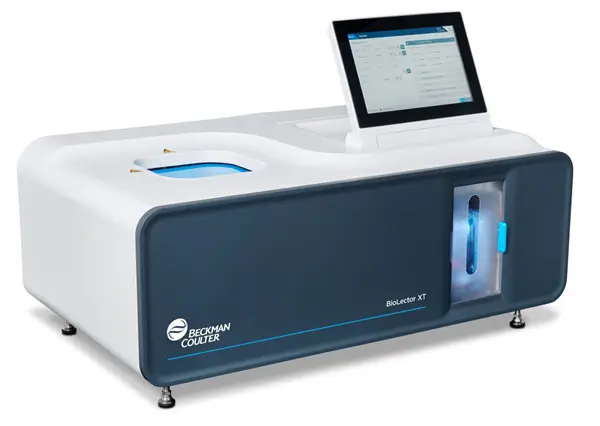
Microbiorreator para cultivos paralelos em alto rendimento com placas de 48-96 poços (volumes: 800-2400 µL). Sistema de monitoramento óptico não invasivo para biomassa (luz dispersa), pH (faixa 4-7.5), DO (0-100%) e fluorescência em tempo real.
Tecnologia microfluídica patenteada para controle individual de gaseificação e alimentação contínua. Capacidade para fed-batch anaeróbico e aeróbico com alta correlação de kLa para scale-up. Aplicações principais: otimização de condições de crescimento, seleção de cepas microbianas e celulares, screening de meios de cultura.
Biorreatores de bancada para desenvolvimento laboratorial
Biorreatores de bancada constituem a base do desenvolvimento de bioprocessos, permitindo validação de parâmetros em volumes de 2-10 litros com controle preciso. Dois designs predominam: sistemas esterilizáveis in situ (SIP) e sistemas autoclaváveis, cada um com vantagens específicas para diferentes aplicações.
Sistemas SIP como o biorreator KLF oferecem esterilização rápida do meio com mínimo impacto em componentes sensíveis ao calor. Sistemas autoclaváveis como o biorreator RALF priorizam modularidade e flexibilidade experimental com condensador colapsível para redução de espaço em autoclave.
Biorreator KLF - Bioengineering AG

Biorreator esterilizável in situ (SIP) com vasos de vidro em volumes de 2.4-3.7 L. Acionamento inferior com selo mecânico de alta performance (30-2800 rpm). Configurações de agitação radial (Rushton) para cultivo microbiano de alto kLa (>300 h⁻¹) ou axial (propeller) para cultura celular com baixo cisalhamento.
Controle preciso de pH, DO, temperatura via jaqueta de aquecimento/resfriamento e pressão opcional. Versão KLFM otimizada para fermentação microbiana com alta transferência de oxigênio. Versão KLFC para cultura celular com perfusão via filtro rotor e mistura em baixa velocidade.
Biorreator RALF - Bioengineering AG

Biorreator autoclavável com design modular em volumes de 2-6.7 L. Acionamento superior mecânico (20-1500 rpm) com vasos de parede simples ou dupla. Versões Basic e Advanced para cultivo microbiano (1 canal de gás pulsado) ou celular (3 canais: Air/O₂/CO₂).
Controle integrado via software BioSCADA para agitação, pH, DO e controle de foam/nível. Condensador colapsível para redução de espaço em autoclave. Aplicações em processos batch, fed-batch e perfusão com automação completa para aquisição de dados e controle de bioprocessos.
KLF oferece vantagem em esterilização SIP para processos que exigem mudanças frequentes de meio. RALF destaca-se em modularidade para experimentos multifatoriais com diferentes configurações de vasos.
Biorreatores de escala piloto para transição produtiva
A escala piloto representa a ponte crítica entre desenvolvimento laboratorial e produção industrial, validando parâmetros de processo em volumes de 10-1000 L. Nesta etapa, aspectos como transferência de massa, homogeneidade de mistura e conformidade regulatória tornam-se determinantes para o sucesso do scale-up.
Estudos de escalonamento demonstram que a manutenção de kLa constante e o uso de simulações CFD (Computational Fluid Dynamics) minimizam heterogeneidades durante a transição de volumes. Biorreatores piloto com tecnologia GMP facilitam a validação de processos para produção clínica.
Biorreator NLF - Bioengineering AG

Biorreator em aço inoxidável com parede dupla em volumes de 11-20 L. Acionamento inferior (100-1500 rpm) com opções de agitação Rushton, marine e pitched-blade para otimização de transferência de massa conforme tipo de cultivo.
Automação semi ou plena com esterilização SIP/CIP integrada. Até 8 linhas de gaseificação com controladores de fluxo mássico (MFCs) para controle preciso de mistura gasosa. Design escalável compatível com requisitos GMP para transição direta à produção clínica.
Biorreator LP/P - Bioengineering AG

Biorreator escalável em aço inoxidável com volumes de 28-1000 L. Acionamento inferior com sistema de cinto para baixa altura de instalação, facilitando acesso ao teto em instalações com restrição de pé-direito. Tecnologia GMP nativa para produção clínica.
Opções de agitação incluem Rushton, propeller e vibromixer para otimização conforme características reológicas do cultivo. Até 8 linhas de gás com soluções para perfusão e gaseificação sem bolhas. Aplicações em fermentação batch e contínua com escalonamento validado para produção farmacêutica.
Plantas industriais de biorreatores para produção em larga escala
Biorreatores industriais com volumes acima de 1.000 litros demandam engenharia personalizada para atender especificidades de cada bioprocesso. Heterogeneidades em gradientes de nutrientes, oxigênio e pH tornam-se críticas em volumes elevados, exigindo modelagem computacional e validação extensiva durante projeto e comissionamento.
Estudos de bioprocessos em larga escala demonstram que o scale-up baseado em kLa constante combinado com simulações CFD minimiza perdas de rendimento em transições de volume. Sistemas de controle avançado com análise de gases de exaustão permitem otimização em tempo real da eficiência metabólica.
Planta Biofermentadores - Bioengineering AG

Sistemas personalizados de fermentação em aço inoxidável com capacidades até 50.000 litros. Projeto sob medida para cultivo microbiano sensível com suporte técnico integral desde engenharia básica até comissionamento e validação.
Esterilização SIP/CIP com validação de ciclos, controle avançado de pH, DO, redox, densidade óptica, peso e análise de gases de exaustão. Integração com sistemas de automação BioSCADA para monitoramento e controle de bioprocessos em larga escala.
Biorreator de Produção - Bioengineering AG

Biorreatores de produção em aço inoxidável com volumes de 30-25.000 litros. Design especializado para crescimento celular sensível com soluções integradas de esterilização e controle de processo.
Sistemas configuráveis para fermentação microbiana de alta demanda de oxigênio ou cultura celular com requisitos de baixo cisalhamento. Automação completa com integração a sistemas MES/LIMS para rastreabilidade e conformidade regulatória em produção farmacêutica.
Comparação técnica entre biorreatores por escala e aplicação
A seleção do biorreator adequado requer análise cruzada de múltiplos parâmetros técnicos. A tabela comparativa a seguir sintetiza as características principais de cada equipamento, facilitando a tomada de decisão baseada em requisitos específicos do bioprocesso.
| Equipamento | Volume | Características Técnicas | Aplicações |
|---|---|---|---|
| BioLector XT | 0,8-2,4 mL | Monitoramento óptico (biomassa, pH, DO); microfluídica; 48-96 cultivos paralelos | Screening alto rendimento; otimização inicial |
| KLF | 2,4-3,7 L | SIP; acionamento inferior (30-2800 rpm); baffles; controle de pressão | Desenvolvimento laboratorial; esterilização rápida |
| RALF | 2-6,7 L | Autoclavável; modular; BioSCADA; 1-3 canais de gás | Processos batch/fed-batch; automação de dados |
| NLF | 11-20 L | Parede dupla; CIP/SIP; até 8 linhas de gás; GMP | Produção piloto; scale-up validado |
| LP/P | 28-1000 L | Escalável; GMP; acionamento inferior baixa altura | Escalonamento clínico; produção pequena-média |
| Plantas Biofermentadores | Até 50.000 L | Personalizadas; suporte técnico integral; análise de exaustão | Produção industrial; biofármacos |
Checklist para seleção de biorreatores
O processo de decisão para seleção de biorreatores segue uma sequência lógica baseada em requisitos do bioprocesso. O checklist abaixo orienta a análise sistemática dos critérios técnicos determinantes.
- Volume alvo: <1 L (BioLector); 1-10 L (KLF/RALF); 10-1000 L (NLF/LP/P); >1000 L (Plantas)
- Throughput: Alto rendimento requer microbiorreatores paralelos (BioLector)
- Conformidade GMP: Produção clínica demanda NLF, LP/P ou plantas personalizadas
- Cultivo microbiano (alto OTR): KLF ou NLF com agitação Rushton
- Cultura celular (baixo cisalhamento): KLFC, RALF ou LP/P com agitação axial
- Automação: Software BioSCADA para monitoramento e controle integrado
- Manutenção: Calibração semanal de sensores; verificação de selos mecânicos
A progressão recomendada para desenvolvimento de bioprocessos inicia com screening em BioLector, validação em bancada (KLF/RALF), escalonamento piloto (NLF/LP/P) e produção industrial em plantas personalizadas.
Controle de pH e DO em biorreatores
O controle preciso de parâmetros ambientais determina a reprodutibilidade e eficiência de bioprocessos. Sistemas modernos de biorreatores integram sensores inline com algoritmos de controle PID para manutenção de condições otimizadas durante todo o cultivo.
Controle DO
O oxigênio dissolvido (DO) representa um dos parâmetros mais críticos, especialmente em cultivos aeróbicos de alta densidade celular. O coeficiente volumétrico de transferência de oxigênio (kLa) quantifica a capacidade do sistema em suprir a demanda metabólica, variando de 50 h⁻¹ em sistemas de baixa agitação até valores superiores a 500 h⁻¹ em microbiorreatores otimizados.
Controle pH
O pH influencia diretamente a atividade enzimática e estabilidade de produtos, requerendo controle em faixas estreitas conforme o organismo cultivado. Sistemas típicos operam entre pH 2-12 com precisão de ±0.1 unidades. A temperatura afeta cinética de crescimento e formação de produtos, com controle via jaquetas de aquecimento/resfriamento em faixas de 4-80°C.
Integração de biorreatores com processos downstream
A eficiência global de bioprocessos depende da integração entre etapas de cultivo (upstream) e purificação (downstream). Biorreatores modernos incorporam recursos que facilitam esta conexão, como sistemas de colheita contínua, filtração tangencial integrada e transferência asséptica para equipamentos de purificação.
Processos de perfusão em biorreatores como KLFC, RALF e LP/P permitem operação contínua com retenção celular, aumentando produtividade volumétrica e viabilizando integração com cromatografia contínua. Esta abordagem reduz volumes de processamento downstream e melhora consistência de produto.
FAQ: Perguntas frequentes sobre seleção de biorreatores
Qual a diferença entre biorreatores SIP e autoclaváveis?
Biorreatores SIP (Steam-In-Place) realizam esterilização in situ via injeção de vapor, permitindo ciclos rápidos sem desmontagem. Sistemas autoclaváveis requerem remoção do vaso para esterilização externa, oferecendo maior flexibilidade em configurações modulares. SIP é preferencial para processos com trocas frequentes de meio; autoclaváveis para experimentação diversificada.
Como escolher entre agitação radial e axial?
Agitação radial (impellers Rushton) gera alto cisalhamento e transferência de oxigênio, ideal para cultivos microbianos aeróbicos. Agitação axial (marine/pitched-blade) proporciona mistura gentil com baixo cisalhamento, adequada para células animais e processos sensíveis. A escolha depende do organismo cultivado e requisitos de transferência de massa.
Qual o volume ideal para iniciar desenvolvimento de bioprocessos?
Recomenda-se iniciar com microbiorreatores (0.8-2.4 mL) para screening de condições e seleção de cepas, seguido de validação em bancada (2-7 L) para estabelecimento de parâmetros de processo. Esta progressão minimiza consumo de insumos e acelera otimização antes de investimentos em escalas maiores.
Quando biorreatores piloto são necessários?
Escala piloto (10-1000 L) é essencial para validação de transferência de massa, homogeneidade de mistura e parâmetros regulatórios antes de produção industrial. Processos destinados a produção GMP requerem dados de piloto para submissões regulatórias e estabelecimento de especificações de processo.
Como o kLa influencia a seleção de biorreatores?
O coeficiente volumétrico de transferência de oxigênio (kLa) determina a capacidade máxima de suprimento de oxigênio. Cultivos de alta densidade celular exigem kLa elevado (>300 h⁻¹), demandando sistemas com agitação intensa e gaseificação otimizada. Células animais operam com kLa moderado (50-150 h⁻¹) para evitar danos por cisalhamento.
Quais requisitos definem conformidade GMP em biorreatores?
Conformidade GMP requer: esterilização validada (SIP/CIP), materiais de construção rastreáveis, acabamento sanitário de superfícies, instrumentação calibrada com certificados, documentação de qualificação (IQ/OQ/PQ) e integração com sistemas de automação validados. Biorreatores NLF, LP/P e plantas industriais atendem nativamente estes requisitos.
Como modelagem CFD auxilia no scale-up de biorreatores?
Simulações de dinâmica de fluidos computacional (CFD) predizem perfis de mistura, gradientes de concentração e zonas de estresse mecânico em diferentes escalas. Esta ferramenta permite otimização de geometria de impellers, posicionamento de spargers e estratégias de aeração antes de fabricação, reduzindo iterações experimentais durante scale-up.








